

高等学校化学学报 ›› 2016, Vol. 37 ›› Issue (6): 1059.doi: 10.7503/cjcu20160029
史蕾1( ), 杨文聪1, 曾淑莹1, 莫婷婷1, 张召2, 曹曼丽1, 刘海洋2(
), 杨文聪1, 曾淑莹1, 莫婷婷1, 张召2, 曹曼丽1, 刘海洋2( )
)
收稿日期:2016-01-13
出版日期:2016-06-10
发布日期:2016-05-26
作者简介:联系人简介: 史蕾, 女, 博士, 讲师, 主要从事咔咯大环化合物的合成及生物学性质研究. E-mail:基金资助:
SHI Lei1,*( ), YANG Wencong1, ZENG Shuying1, MO Tingting1, ZHANG Zhao2, CAO Manli1, LIU Haiyang2,*(
), YANG Wencong1, ZENG Shuying1, MO Tingting1, ZHANG Zhao2, CAO Manli1, LIU Haiyang2,*( )
)
Received:2016-01-13
Online:2016-06-10
Published:2016-05-26
Contact:
SHI Lei,LIU Haiyang
E-mail:shil@gdei.edu.cn;chhyliu@scut.edu.cn
Supported by:摘要:
合成了10-(4-羟基苯基)-5,15-二(五氟苯基)咔咯钴(Ⅲ)配合物(1-Co)和10-(4-吩噻嗪苯基)-5,15-二(五氟苯基)咔咯钴(Ⅲ)配合物(2-Co), 并采用核磁共振波谱、 质谱和紫外-可见光谱等对其结构进行了表征, 利用紫外光谱、 荧光光谱、 圆二色谱、 黏度测试和琼脂糖凝胶电泳等技术研究了配合物1-Co和2-Co与小牛胸腺DNA(ct-DNA)之间的相互作用. 结果表明, 配合物1-Co和2-Co与DNA之间的作用模式为外部结合, 且在光照下均能引发DNA断裂. 细胞毒性实验结果表明, 配合物1-Co和2-Co具有很低的暗细胞毒性, 但在光照条件下均能有效抑制H460, HeLa, A549等肿瘤细胞株增殖, 表明配合物1-Co和2-Co在光动力治疗中具有潜在的应用价值. 细胞核染色和线粒体膜电位检测结果表明, 在光照条件下配合物2-Co可能是通过氧化损伤线粒体的途径抑制肿瘤细胞增殖.
中图分类号:
TrendMD:
史蕾, 杨文聪, 曾淑莹, 莫婷婷, 张召, 曹曼丽, 刘海洋. 咔咯钴(Ⅲ)配合物与DNA的相互作用及抗肿瘤活性. 高等学校化学学报, 2016, 37(6): 1059.
SHI Lei, YANG Wencong, ZENG Shuying, MO Tingting, ZHANG Zhao, CAO Manli, LIU Haiyang. DNA-binding and Anti-tumor Activities of Cobalt Corrole Complexes†. Chem. J. Chinese Universities, 2016, 37(6): 1059.
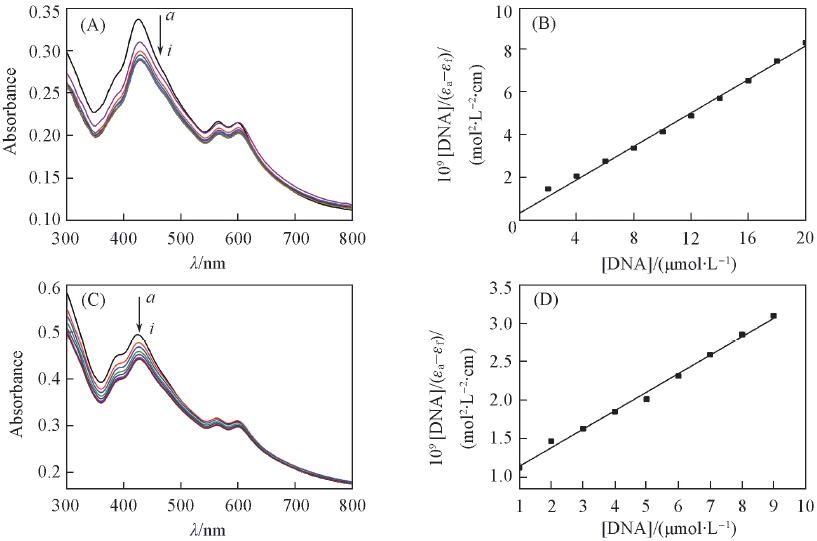
Fig.1 Changes in the UV-Vis spectra of complexes 1-Co(A), 2-Co(C)(1×10-5 mol/L) upon addition of ct-DNA and relationships between [DNA]/∣εa-εf∣and [DNA] during the interaction between 1-Co(B), 2-Co(D) and ct-DNA(A) [DNA]/(μmol·L-1) from a to j: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20; (C) [DNA]/(μmol·L-1) from a to i: 1, 2, 3, 4, 5, 6, 7, 8, 9.
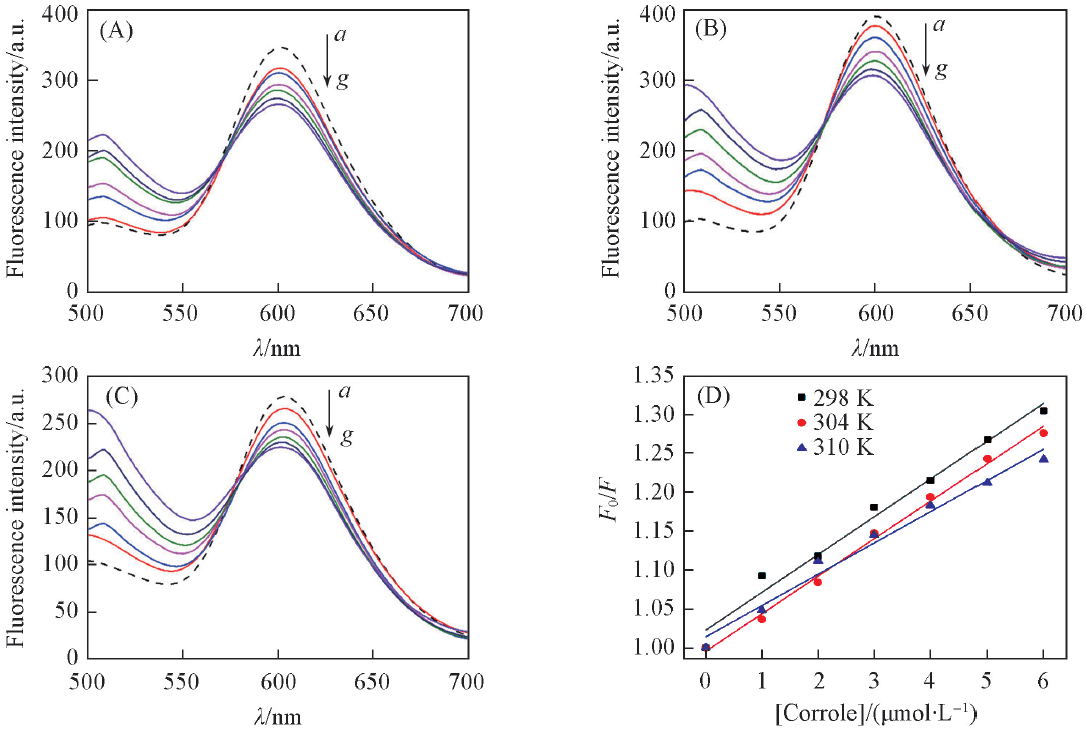
Fig.2 Changes in the fluorescence spectra of ct-DNA-EB system upon addition of complex 1-Co at 298 K(A), 304 K(B), 310 K(C) and the plot of F0/F versus [1-Co] at different temperatures(D)[1-Co]/(μmol/L) from a to g: 0, 1, 2, 3, 4, 5, 6.
| Complex | Temperature/K | KSV/(L·mol-1) | Kq/(L·mol-1·s-1) | R |
|---|---|---|---|---|
| 1-Co | 298 | 5.22×104 | 5.22×1012 | 0.994 |
| 304 | 3.12×104 | 3.12×1012 | 0.973 | |
| 310 | 2.41×104 | 2.41×1012 | 0.970 | |
| 2-Co | 298 | 4.87×104 | 4.87×1012 | 0.978 |
| 304 | 4.83×104 | 4.83×1012 | 0.994 | |
| 310 | 4.03×104 | 4.03×1012 | 0.977 |
Table 1 Binding parameters of complexes 1-Co and 2-Co with DNA at different temperatures
| Complex | Temperature/K | KSV/(L·mol-1) | Kq/(L·mol-1·s-1) | R |
|---|---|---|---|---|
| 1-Co | 298 | 5.22×104 | 5.22×1012 | 0.994 |
| 304 | 3.12×104 | 3.12×1012 | 0.973 | |
| 310 | 2.41×104 | 2.41×1012 | 0.970 | |
| 2-Co | 298 | 4.87×104 | 4.87×1012 | 0.978 |
| 304 | 4.83×104 | 4.83×1012 | 0.994 | |
| 310 | 4.03×104 | 4.03×1012 | 0.977 |
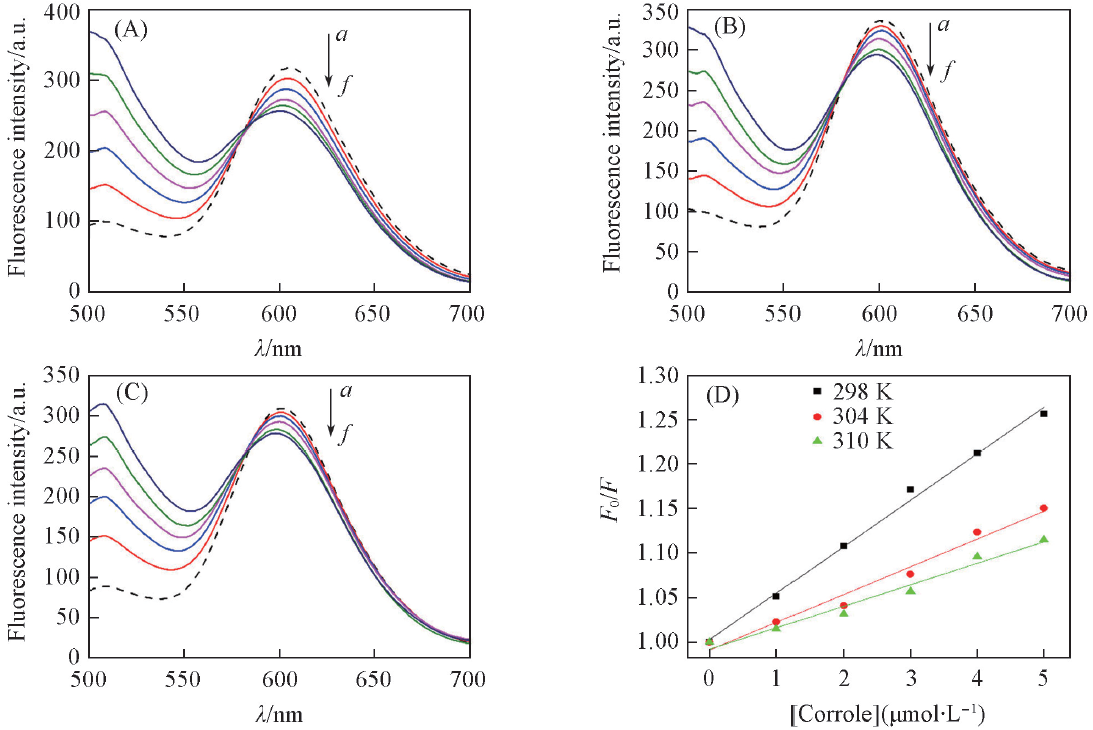
Fig.3 Changes in the fluorescence spectra of ct-DNA-EB system upon addition of complex 2-Co at 298 K(A), 304 K(B), 310 K(C) and the plot of F0/F versus [2-Co] at different temperatures(D)[2-Co]/(μmol·L-1) from a to f: 0, 1, 2, 3, 4, 5.

Fig.7 Agarose gel electrophoresis patterns of 1-Co(A) or 2-Co(B) for the cleavage of supercoiled pBR 322 DNA(T=298 K)Reaction mixtures(10 μL) contained 0.1 μg of plasmid DNA, 1-Co or 2-Co. (A) Lane 1: DNA alone; lane 2: DNA(hν 2 h); lane 3: DNA+320 μmol/L 1-Co(no hν); lanes 4—8: DNA+40, 100, 160, 240, 320 μmol/L 1-Co respectively(hν 2 h). (B) Lane 1: DNA alone; lane 2: DNA(hν 2 h); lane 3: DNA+320 μmol/L 2-Co(no hν); lanes 4―8: DNA+40, 100, 160, 240, 320 μmol/L 2-Co respectively(hν 2 h).
| Complex | H460 | Hela | A549 | |||
|---|---|---|---|---|---|---|
| Dark | Light | Dark | Light | Dark | Light | |
| 1-Co | 84±5.1 | 29±3.2 | 104±5.7 | 36±2.9 | 113±5.1 | 31±2.8 |
| 2-Co | 52±2.7 | 20±3.9 | 76±3.6 | 24±2.6 | 47±1.9 | 29±2.7 |
Table 2 Inhibitory activity[IC50/(μmol·L-1)] of complex 1-Co or 2-Co against selected cell lines
| Complex | H460 | Hela | A549 | |||
|---|---|---|---|---|---|---|
| Dark | Light | Dark | Light | Dark | Light | |
| 1-Co | 84±5.1 | 29±3.2 | 104±5.7 | 36±2.9 | 113±5.1 | 31±2.8 |
| 2-Co | 52±2.7 | 20±3.9 | 76±3.6 | 24±2.6 | 47±1.9 | 29±2.7 |
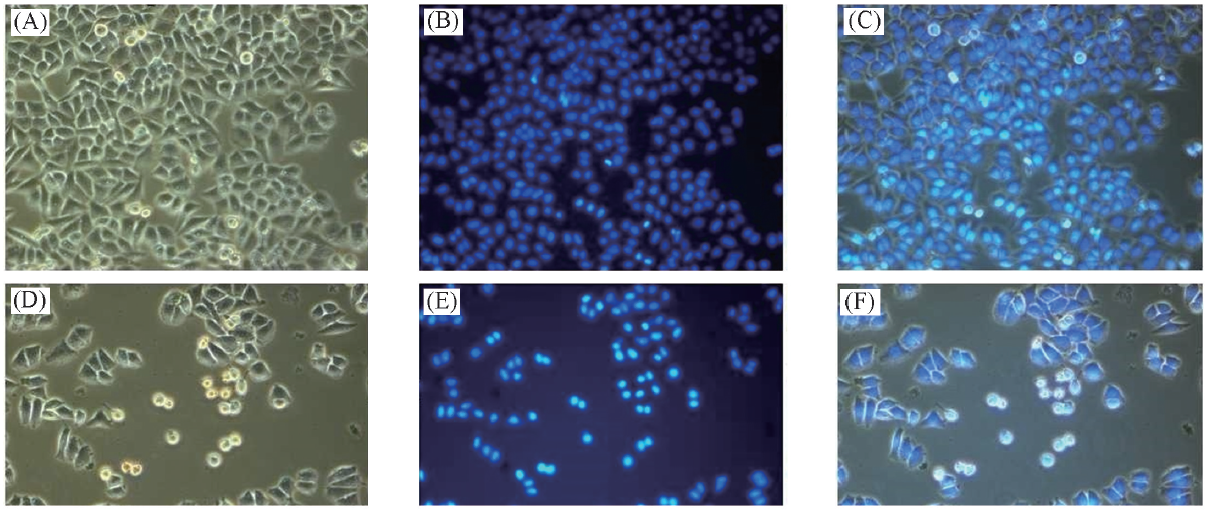
Fig.8 Fluorescence microscopic images of Hoechst-33342-stained H460 cells after treatment with complex 2-Co(20 μmol/L) for 24 h(×200)(A) Control+bright field; (B) control+hoechst; (C) control+merge; (D) 2-Co+bright field;(E) 2-Co+hoechst; (F) 2-Co+merge.
| [1] | Ding Y. B., Tang Y. Y., Zhu W. H., Xie Y. S., Chem. Soc. Rev., 2015, 44, 1101—1112 |
| [2] | Xie Y. S., Tang Y. Y., Wu W. J., Wang Y. Q., Liu J. C., Li X., Tian H., Zhu W. H., J. Am. Chem. Soc., 2015, 137, 14055—14058 |
| [3] | Wei T. T., Sun X., Li X., Ågren H., Xie Y. S., ACS Appl. Mater. Interfaces, 2015, 7, 21956—21965 |
| [4] | Wang Y. Q., Chen B., Wu W. J., Li X., Zhu W. H., Tian H., Xie Y. S., Angew. Chem. Int. Ed., 2014, 53, 10779—10783 |
| [5] | Mi Y. S., Liang P. X., Yang Z., Wang D., Cao H., He W. L., Yang H., Chem. Res. Chinese Universities, 2015, 31(6), 992—996 |
| [6] | Vanya B., Lidiya P., Pavel K., Photochem. Photobiol. B-Biology, 2015, 153, 276—280 |
| [7] | Liu H. Y., Mahmood M. H. R., Qiu S. X., Chang C. K., Coord. Chem. Rev., 2013, 267, 1306—1333 |
| [8] | Aviv-Harel I., Gross Z., Coord. Chem. Rev., 2011, 255, 717—736 |
| [9] | Chang C. K., Kong P. W., Liu H. Y., Yeung L. L., Koon H. K., Mak N. K., Proc. SPIE, 2006, 6139, 613915 |
| [10] | Agadjanian H., Ma J., Rentsendorj A., Valluripalli V., Hwang J. Y., Mahammed A., Farkas D. L., Gray H. B., Gross Z., Medina-Kauwe L. K., Proc. Natl. Acad. Sci., 2009, 106, 6105—6110 |
| [11] | Haber A., Mahammed A., Fuhrman B., Volkova N., Coleman R., Hayek T., Aviram M., Gross Z., Angew. Chem. Int. Ed., 2008, 47, 7896—7900 |
| [12] | Gossens C., Tavernelli I., Rothlisberger U., J. Am. Chem. Soc., 2008, 130, 10921—10928 |
| [13] | An D., Zhao X. H., Zhou M., Ye Z. W., Chem. J. Chinese Universities, 2014, 35(2), 275—280 |
| (安东, 赵晓辉, 周密, 叶志文. 高等学校化学学报, 2014, 35(2), 275—280) | |
| [14] | Li X. L., Ma D. L., Yang H. L., Tan G. H., Du H. R., Wang K. R., Zhang P. Z., Chen H., Chem. J. Chinese Universities, 2014, 35(6), 1181—1188 |
| (李小六, 马东来, 杨海龙, 谭官海, 杜会茹, 王克让, 张平竹, 陈华. 高等学校化学学报, 2014, 35(6), 1181—1188) | |
| [15] | Zhang H., Liu C. S., Bu X. H., Yang M., J. Inorg. Biochem., 2005, 99, 1119—1125 |
| [16] | Wang J. M., Shi L., Liu H. Y., Prog. Chem., 2015, 27(6), 755—762 |
| (王家敏, 史蕾, 刘海洋. 化学进展, 2015, 27(6), 755—762) | |
| [17] | Shi L., Liu H. Y., Peng K. M., Wang X. L., You L. L., Lu J., Zhang L., Wang H., Ji L. N., Jiang H. F., Tetrahedron. Lett., 2010, 51, 3439—3442 |
| [18] | Huang J. T., Zhang Y., Wang X. L., Ji L. N., Liu H. Y., Chinese J. Inorg. Chem., 2013, 29(8), 1649—1656 |
| (黄俊腾, 张阳, 王湘利, 计亮年, 刘海洋. 无机化学学报, 2013, 29(8), 1649—1656 | |
| [19] | Zhang Y., Chen H., Wen J. Y., Wang X. L., Wang H., Ji L. N., Liu H. Y., Chem. J. Chinese Universities, 2013, 34(11), 2462—2469 |
| (张阳, 陈欢, 闻金燕, 王湘利, 王惠, 计亮年, 刘海洋. 高等学校化学学报, 2013, 34(11), 2462—2469) | |
| [20] | Zhang Y., Wen J. Y., Wang X. L., Mahmood M. H. R., Liu Z. Y., Wang H., Ji L. N., Liu H. Y., Appl. Organometal. Chem., 2014, 28, 559—566 |
| [21] | Fu B.Q., Huang J., Ren L., Weng X. C., Zhou Y. Y., Du Y. H., Wu X. J., Zhou X., Yang G. F.,Chem. Commun., 2007, 3264—3266 |
| [22] | Fu B. Q., Zhang D., Weng X. C., Zhang M., Ma H., Ma Y. Z., Zhou X., Chem. Eur. J., 2008, 14, 9431—9441 |
| [23] | Ma H., Zhang M., Zhang D., Huang R., Zhao Y., Yang H., Liu Y. J., Weng X. C., Zhou Y. Y., Deng M. G., Xu L., Zhou X., Chem. Asian J., 2010, 5, 114—122 |
| [24] | Durso A., Nardis S., Pomarico G., Fragal M. E., Paolesse R., Purrello R., J. Am. Chem. Soc., 2013, 135, 8632—8638 |
| [25] | Cannon J. R., Johnson A. W., Todd A. R., Nature, 1954, 174, 1168—1169 |
| [26] | Djinovic K., Coda A., Antolini L., J. Mol. Biol., 1992, 226, 227—238 |
| [27] | Lv J., Liu T. T., Cai S. L., Wang X., Liu L., Wang Y. M., J. Inorg. Biochem., 2006, 100, 1888—1896 |
| [28] | Singh K., Kumar Y., Puri P., Kumar M., Sharma C., Eur. J. Med. Chem., 2012, 52, 313—321 |
| [29] | López-Sandoval H., Londono-Lemos M. E., Garza-Velasco R., Poblano-Meléndez I., Granada-Macías P., Gracia-Mora I., Barba-Behrens N., J. Inorg. Biochem., 2008, 102, 1267—1276 |
| [30] | Ott I., Abraham A., Schumacher P., Shorafa H., Gastl G., Gust R., Kircher B., J. Inorg. Biochem., 2006, 100, 1903—1906 |
| [31] | Dimiza F., Papadopoulos A. N., Tangoulis V., Psycharis V., Raptopoulou C. P., Kessisso-glou D. P., Psomas G., Dalton. Trans., 2010, 39, 4517—4528 |
| [32] | Dimiza F., Papadopoulos A. N., Tangoulis V., Psycharis V., Raptopoulou C. P., Kessisso-glou D. P., Psomas G., J. Inorg. Biochem., 2012, 107, 54—64 |
| [33] | Farinas E. T., Tan J. D., Mascharak P. K., Inorg. Chem., 1996, 35, 2637—2643 |
| [34] | Lu W. J., Wang H. M., Yuann J. M. P., Huang C. Y., Hou M. H., J. Inorg. Biochem., 2009, 103, 1626—1633 |
| [35] | Sun Y., Hou Y. J., Zhou Q. X., Lei W. H., Chen J. R., Wang X. S., Zhang B. W., Inorg. Chem., 2010, 49, 10108—10116 |
| [36] | Wolfe A., Shimer G. H., Meehan T., Biochem., 1987, 26, 6392—6396 |
| [37] | Lakowicz J. R., Webber G., Biochem., 1973, 12, 4161—4170 |
| [38] | Satyanarayana S., Dabrowiak J. C., Chaires J. B., Biochem., 1993, 32, 2573—2584 |
| [39] | Zhang Z., Wen J. Y., Lv B. B., Li X., Ying X., Wang Y. J., Zhang H. T., Wang H., Liu H. Y., Chang C. K., Appl. Organometal. Chem., 2016, 30, 132—139 |
| [40] | Pasternack R. F., Gibbs E. J., Villafranca J. J., Biochem., 1983, 22, 2406—2414 |
| [41] | LePecq J. B., Paoletti C., J. Mol. Biol., 1967, 27, 87—106 |
| [42] | Yun-Kai L. V., Li P., Jiao M. L., Liu B. S., Yang C., Turk. J. Chem., 2014, 38, 202—209 |
| [43] | Sun Y. T., Peng T. T., Zhao L., Jiang D. Y., Cui Y. C., J. Lumin., 2014, 156, 108—115 |
| [44] | Ivanov V. I., Minchenkova L. E., Schyolkina A. K., Poletayev A. I., Biopolymers, 1973, 12, 89—110 |
| [45] | Nordén B., Tjerneld F., Biopolymers, 1982, 21, 1713—1734 |
| [46] | Satyanarayana S., Dabrowiak J. C., Chaires J. B., Biochem., 1992, 31, 9319—9324 |
| [47] | Ji L. N., Zhou X. H., Liu J. G., Coord. Chem. Rev., 2001, 216, 513—536 |
| [48] | Inclán M., Albelda M. T., Frías J. C., Blasco S., Verdejo B., Serena C., Salat-Canela C., Díaz M. L., García-España A., García-España E., J. Am. Chem. Soc., 2012, 134, 9644—9656 |
| [49] | Qi L., Ding Y. Q., Scientia Sinica Vitae, 2013, 43(11), 939—946 |
| [50] | Xiang J. Y., Xia X. S., Jiang Y., Leung A. W. N, Wang X. N., Xu J., Wang P., Yu H. P., Bai D. Q., Xu C. S., Ultrasonics, 2011, 51, 390—395 |
| [51] | Domingo-Gil E., Esteban M., Apoptosis., 2006, 11, 725—738 |
| [52] | Zhao C. Q., Zhang Y. H., Jiang S. D., Jiang L. S., Dai L. Y., AGE, 2010, 32, 161—177 |
| [53] | Green D. R., Reed J. C., Science, 1998, 28, 1309—1312 |
| [54] | Reers M., Smiley S. T., Mottola-Hartshorn C., Chen A., Lin M., Chen L. B., Method Enzymol., 1995, 260, 406—414 |
| [1] | 刘苏毓, 丁飞, 李茜, 樊春海, 冯景. 偶氮苯类DNA纳米机器[J]. 高等学校化学学报, 2022, 43(8): 20220122. |
| [2] | 仵宇帅, 尚颖旭, 蒋乔, 丁宝全. 可控自组装DNA折纸结构作为药物载体的研究进展[J]. 高等学校化学学报, 2022, 43(8): 20220179. |
| [3] | 邱丽琪, 姚向阳, 何良年. 可见光驱动丰产金属卟啉类配合物催化的二氧化碳选择性还原反应[J]. 高等学校化学学报, 2022, 43(7): 20220064. |
| [4] | 王君旸, 刘争, 张茜, 孙春燕, 李红霞. DNA银纳米簇在功能核酸荧光生物传感器中的应用[J]. 高等学校化学学报, 2022, 43(6): 20220010. |
| [5] | 徐丹丹, 邹修成, 罗静, 刘仁. 吩噻嗪席夫碱可见光引发剂的合成与性能[J]. 高等学校化学学报, 2022, 43(4): 20210857. |
| [6] | 俞彬, 谌小燕, 赵越, 陈卫昌, 肖新颜, 刘海洋. 氧化石墨烯基钴卟啉复合材料的电催化析氢反应[J]. 高等学校化学学报, 2022, 43(2): 20210549. |
| [7] | 朱琪琛, 熊明, 陶思羽, 唐思危, 任奇志. 光源的选择对水溶性磺酸卟啉光催化对萘二酚类物质催化性能的影响[J]. 高等学校化学学报, 2021, 42(6): 1933. |
| [8] | 吴杨仪, 陈建平, 艾益静, 汪庆祥, 高飞, 高凤. 2-(2-羟基-3-甲氧基苯基)-C60的合成及在花椰菜花叶病毒启动子DNA传感检测中的应用[J]. 高等学校化学学报, 2021, 42(6): 1754. |
| [9] | 马子辉, 王梦妍, 曹洪玉, 唐乾, 王立皓, 郑学仿. 光激发金属配位四苯基卟啉瞬态吸收和衰减动力学性质研究[J]. 高等学校化学学报, 2021, 42(3): 767. |
| [10] | 杨新杰, 赖艳琼, 李秋旸, 张艳丽, 王红斌, 庞鹏飞, 杨文荣. 基于环状DNA-银纳米簇荧光探针对微囊藻毒素-LR的传感检测[J]. 高等学校化学学报, 2021, 42(12): 3600. |
| [11] | 刘学娇, 杨帆, 刘爽, 张春娟, 刘巧玲. 核酸适体靶向的膜蛋白识别与功能调控研究进展[J]. 高等学校化学学报, 2021, 42(11): 3277. |
| [12] | 任玉双, 郭园园, 刘学怡, 宋杰, 张川. 顺铂前药接枝修饰硫代DNA及其自组装靶向纳米药物研究[J]. 高等学校化学学报, 2020, 41(8): 1721. |
| [13] | 谢兴钰, 赵雅香, 赵莉芝, 李日舜, 吴迪昊, 叶卉, 辛清萍, 李泓, 张玉忠. 基于金属卟啉2DMOFs仿酶催化的过氧化氢比色法检测[J]. 高等学校化学学报, 2020, 41(8): 1776. |
| [14] | 张开翔, 刘军杰, 宋巧丽, 王丹钰, 史进进, 张海悦, 李景虹. 基于DNA纳米花的细胞自噬基因沉默用于增敏抗肿瘤化疗[J]. 高等学校化学学报, 2020, 41(7): 1461. |
| [15] | 严磊, 毛秀海, 左小磊. 框架核酸辅助的仿生膜构建[J]. 高等学校化学学报, 2020, 41(7): 1415. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||