

高等学校化学学报 ›› 2024, Vol. 45 ›› Issue (5): 20230511.doi: 10.7503/cjcu20230511
收稿日期:2023-12-13
出版日期:2024-05-10
发布日期:2024-02-19
通讯作者:
李霄羽
E-mail:xiaoyuli@bit.edu.cn
基金资助:
LONG Lei1, WEI Wei2, LUO Yunjun1,2, LI Xiaoyu1,2( )
)
Received:2023-12-13
Online:2024-05-10
Published:2024-02-19
Contact:
LI Xiaoyu
E-mail:xiaoyuli@bit.edu.cn
Supported by:摘要:
有机叠氮化合物是一类多功能化合物, 是合成一系列治疗药物、 生物活性化合物、 功能材料及高能化合物有用的前驱体, 被广泛应用于点击化学和Staudinger反应中. 在过去的几十年里, 研究人员开发了大量的合成策略来制备结构多样的有机叠氮化物, 但不是所有的反应都能高效地进行. 随着绿色化学的概念深入人心, 安全性低、 普适性低和效率低的传统叠氮化方法逐渐被淘汰, 发展新的高效叠氮化方法迫在眉睫. 本文综合评述了近年来制备脂肪族叠氮化合物及叠氮聚合物的高效合成方法, 从碳碳多重键和碳氢键的叠氮化策略方面简述了脂肪族叠氮化物的合成, 对叠氮聚合物的合成方法、 潜在的新型合成策略进行了概述, 并对未来叠氮化学的发展前景进行了展望.
中图分类号:
TrendMD:
龙磊, 韦伟, 罗运军, 李霄羽. 高效叠氮化方法研究进展. 高等学校化学学报, 2024, 45(5): 20230511.
LONG Lei, WEI Wei, LUO Yunjun, LI Xiaoyu. Research Progress in Efficient Azide Methods. Chem. J. Chinese Universities, 2024, 45(5): 20230511.
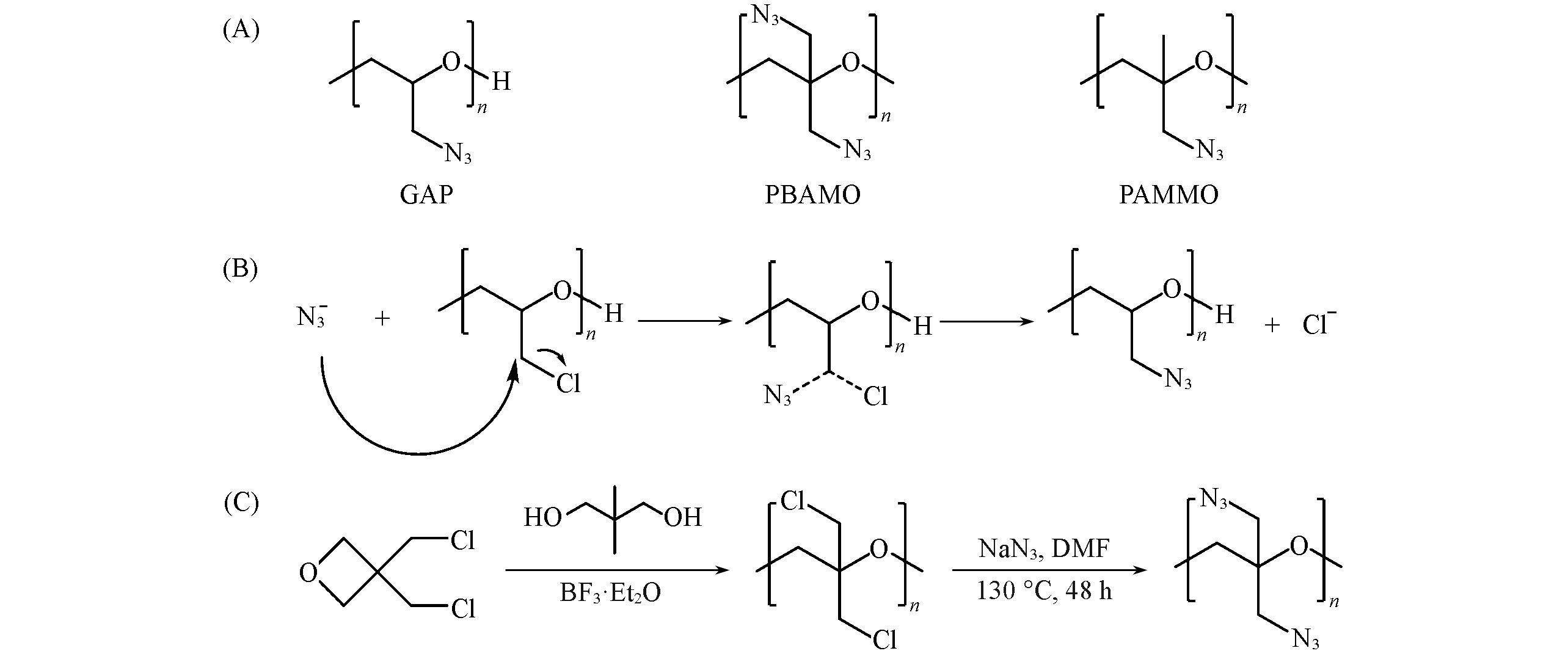
Fig.14 Chemical structural formulas of GAP, PBAMO and PAMMO(A), schematic diagram of azide reaction mechanism(B) and indirect synthesis route of PBAMO(C)
| 1 | Bräse S., Gil C., Knepper K., Zimmermann V., Angew. Chem. Int. Ed., 2005, 44(33), 5188—5240 |
| 2 | Curtius T., J. Prakt. Chem., 1894, 50(1), 275—294 |
| 3 | Köhn M., Breinbauer R., Angew. Chem. Int. Ed., 2004, 43(24), 3106—3116 |
| 4 | Sivaguru P., Ning Y. Q., Bi X. H., Chem. Rev., 2021, 121(7), 4253—4307 |
| 5 | Leggans E. K., Barker T. J., Duncan K. K., Boger D. L., Org. Lett., 2012, 14(6), 1428—1431 |
| 6 | Shirke R. P., Ramasastry S. S. V., Org. Lett., 2017, 19(19), 5482—5485 |
| 7 | Li X. N., Chen P. H., Liu G. S., Sci. Chi. Chem., 2019, 62(11), 1537—1541 |
| 8 | Wang J. J., Yu W., Chem⁃Eur J., 2019, 25(14), 3510—3514 |
| 9 | Zhang B., Studer A., Org. Lett., 2013, 15(17), 4548—4551 |
| 10 | Yin H., Wang T., Jiao N., Org. Lett., 2014, 16(9), 2302—2305 |
| 11 | Yang B., Lu Z., ACS Catal., 2017, 7(12), 8362—8365 |
| 12 | Wei W., Cui H. H., Yue H. L., Yang D. S., Green Chem., 2018, 20(14), 3197—3202 |
| 13 | Siu J. C., Sauer G. S., Saha A., Macey R. L., Fu N. K., Chauviré T., Lancaster K. M., Lin S., J. Am. Chem. Soc., 2018, 140(39), 12511—12520 |
| 14 | Chouthaiwale P. V., Karabal P. U., Suryavanshi G., Sudalai A., Synthesis, 2010, 22, 3879—3882 |
| 15 | Kupracz L., Hartwig J., Wegner J., Ceylan S., Kirschning A., Beilstein. J. Org. Chem., 2011, 7, 1441—1448 |
| 16 | Saikia I., Phukan P., CR. Chim., 2012, 15(8), 688—692 |
| 17 | Li Z. D., Zhang C. W., Zhu L., Liu C., Li C. Z., Org. Chem. Front., 2014, 1(1), 100—104 |
| 18 | Valiulin R. A., Mamidyala S., Finn M. G., J. Org. Chem., 2015, 80(5), 2740—2755 |
| 19 | Rao D. S., Reddy T. R., Gurawa A., Kumar M., Kashyap S., Org. Lett., 2019, 21(24), 9990—9994 |
| 20 | Ge L., Zhou H., Chiou M. F., Jiang H. M., Jian W. J., Ye C. Q., Li X. Y., Zhu X. T., Xiong H. G., Li Y. J., Song L. J., Zhang X. H., Bao H. L., Nat. Catal, 2020, 4(1), 28—35 |
| 21 | Wu L. Q., Zhang Z. H., Wu D. Q., Wang F., Chen P. H., Lin Z. Y., Liu G. S., Angew. Chem. Int. Ed., 2021, 60(13), 6997—7001 |
| 22 | Kamble D. A., Karabal P. U., Chouthaiwale P. V., Sudalai A., Tetrahedron Lett., 2012, 53(32), 4195—4198 |
| 23 | Yuan Y. A., Lu D. F., Chen Y. R., Xu H., Angew. Chem. Int. Ed., 2016, 55(2), 534—538 |
| 24 | Reddy T. R., Rao D. S., Kashyap S., Chem. Commun., 2019, 55(19), 2833—2836 |
| 25 | Siu J. C., Parry J. B., Lin S., J. Am. Chem. Soc., 2019, 141(7), 2825—2831 |
| 26 | Liu W., Pu M. P., He J., Zhang T. H., Dong S. X., Liu X. H., Wu Y. D., Feng X. M., J. Am. Chem. Soc., 2021, 143(30), 11856—11863 |
| 27 | Zhang M. L., Zhang J. H., Li Q. Y., Shi Y. M., Nat. Commun., 2022, 13(1), 7880 |
| 28 | Cai C. Y., Zheng Y. T., Li J. F., Xu H. C., J. Am. Chem. Soc., 2022, 144(27), 11980—11985 |
| 29 | Sequeira F. C., Turnpenny B. W., Chemler S. R., Angew. Chem. Int. Ed., 2010, 49(36), 6365—6368 |
| 30 | Wang L. J., Ren P. X., Qi L., Chen M. M., Lu Y. L., Zhao J. Y., Liu R., Chen J. M., Li W., Org. Lett., 2018, 20(15), 4411—4415 |
| 31 | Shen K., Wang Q., J. Am. Chem. Soc., 2017, 139(37), 13110—13116 |
| 32 | Fayssal S. A., Giungi A., Berhal F., Prestat G., Org. Process Res. Dev., 2020, 24(5), 695—703 |
| 33 | Zhang B., Studer A., Org. Lett., 2014, 16(6), 1790—1793 |
| 34 | Lei B. W., Wang X. J., Ma L. F., Li Y., Li Z. Y., Org. Biomol. Chem., 2018, 16(17), 3109—3113 |
| 35 | Makai S., Falk E., Morandi B., J. Am. Chem. Soc., 2020, 142(51), 21548—21555 |
| 36 | Lv D. Q., Sun Q., Zhou H., Ge L., Qu Y. J., Li T. A., Ma X. X., Li Y., Bao H. L., Angew. Chem. Int. Ed., 2021, 60(22), 12455—12460 |
| 37 | Xu J., Li X. Q., Gao Y. Z., Zhang L. L., Chen W. Z., Fang H., Tang G., Zhao Y. F., Chem. Commun., 2015, 51(56), 11240—11243 |
| 38 | Lu L. X., Fu N. K., Lin S., Synlett, 2019, 30(10), 1199—1203 |
| 39 | Xiong Y., Sun Y. W., Zhang G. Z., Org. Lett., 2018, 20(19), 6250—6254 |
| 40 | Ma H. L., Li Y. Z., Wang P. Q., Ye J. M., Zhang J., Liu G., Wu J., Org. Chem. Front., 2023, 10(4), 866—871 |
| 41 | Arepally S., Babu V. N., Polu A., Sharada D. S., Eur. J. Org. Chem., 2018, 2018(41), 5700—5705 |
| 42 | Zheng L., Wang Z. J., Li C., Wu Y., Liu Z. H., Ning Y. Q., Chem. Commun., 2021, 57(77), 9874—9877 |
| 43 | Hurtado-Rodrigo C., Hoehne S., Munoz M. P., Chem. Commun., 2014, 50(12), 1494—1496 |
| 44 | Khrakovsky D. A., Tao C. Z., Johnson M. W., Thornbury R. T., Shevick S. L., Toste F. D., Angew. Chem. Int. Ed., 2016, 55(20), 6079—6083 |
| 45 | Liu Y. C., Ding N., Tan X. J., Li X. X., Zhao Z. G., Chem. Commun., 2020, 56(54), 7507—7510 |
| 46 | Thirumurugan P., Matosiuk D., Jozwiak K., Chem. Rev., 2013, 113(7), 4905—4979 |
| 47 | Magnus P., Lacour J., J. Am. Chem. Soc., 1992, 114(2), 767—769 |
| 48 | Pedersen C. M., Marinescu L. G., Bols M., Org. Biomol. Chem., 2005, 3(5), 816—822 |
| 49 | Zhdankin V. V., Kuehl C. J., Krasutsky A. P., Formaneck M. S., Bolz J. T., Tetrahedron Lett., 1994, 35(52), 9677—9680 |
| 50 | Zhang X. F., Yang H. D., Tang P. P., Org. Lett., 2015, 17(23), 5828—5831 |
| 51 | Li X., Shi Z. J., Org. Chem. Front., 2016, 3(10), 1326—1330 |
| 52 | Xia Y., Wang L., Studer A., Angew. Chem. Int. Ed., 2018, 57(39), 12940—12944 |
| 53 | Sharma A., Hartwig J. F., Nature, 2015, 517(7536), 600—604 |
| 54 | Huang X. Y., Bergsten T. M., Groves J. T., J. Am. Chem. Soc., 2015, 137(16), 5300—5303 |
| 55 | Torres-Ochoa R. O., Leclair A., Wang Q., Zhu J. P., Chem⁃Eur J., 2019, 25(40), 9477—9484 |
| 56 | Bian K. J., Wang C. Y., Huang Y. L., Xu Y. H., Wang X. S., Org. Biomol. Chem., 2020, 18(28), 5354—5358 |
| 57 | Bian K. J., Li Y., Zhang K. F., He Y., Wu T. R., Wang C. Y., Wang X. S., Chem. Sci., 2020, 11(38), 10437—10443 |
| 58 | Suh S. E., Chen S. J., Mandal M., Guzei I. A., Cramer C. J., Stahl S. S., J. Am. Chem. Soc., 2020, 142(26), 11388—11393 |
| 59 | Cao M., Wang H. L., Ma Y. A., Tung C. H., Liu L., J. Am. Chem. Soc., 2022, 144(33), 15383—15390 |
| 60 | Wang Y. X., Li G. X., Yang G. H., He G., Chen G., Chem. Sci., 2016, 7(4), 2679—2683 |
| 61 | Kamijo S., Watanabe M., Kamijo K., Tao K., Murafuji T. J. S., Synthesis⁃Stuttgart, 2015, 48(1), 115—121 |
| 62 | Margrey K. A., Czaplyski W. L., Nicewicz D. A., Alexanian E. J., J. Am. Chem. Soc., 2018, 140(12), 4213—4217 |
| 63 | Niu L. B., Jiang C. Y., Liang Y. W., Liu D. D., Bu F. X., Shi R. Y., Chen H., Chowdhury A. D., Lei A. W., J. Am. Chem. Soc., 2020, 142(41), 17693—17702 |
| 64 | Meyer T. H., Samanta R. C., Del Vecchio A., Ackermann L., Chem. Sci., 2021, 12(8), 2890—2897 |
| 65 | Young G., Wang H. Y., Zachariah M. R., Propell. Explos. Pyrot., 2015, 40(3), 413—418 |
| 66 | Davenas A., J. Propul. Power, 2003, 19(6), 1108—1128 |
| 67 | Hu J. H., Liu Y. N., Cong K., He J. Y., Yang R. J., Polymers, 2020, 12(5), 1199 |
| 68 | Boopathi S. K., Hadjichristidis N., Gnanou Y., Feng X. S., Nat. Commun., 2019, 10, 293 |
| 69 | Li B. J., Luo Y. J., Zheng J., Polym. Sci. Ser. A+., 2017, 59(3), 301—309 |
| 70 | Jiang K., Deng H. L., Zhang Q., Wang S. F., Wu H., Liu Y., Chai C. P., Huang M. H., Green. Chem., 2018, 20(12), 2813—2820 |
| 71 | Yang Z. Q., Study on the Synthesis and Properties of Cellulose Azide Derivatives, Beijing Institute of Technology, Beijing, 2015 |
| 杨志强. 叠氮化纤维素衍生物的合成与性能研究, 北京: 北京理工大学, 2015 | |
| 72 | Zhang C., Li J., Luo Y. J., Zhang X. F., Zhai B., New Chemical Materials, 2015, 43(5), 174—175 |
| 张弛, 李杰, 罗运军, 张向飞, 翟滨. 化工新型材料, 2015, 43(5), 174—175 | |
| 73 | Zhang C., Li J., Luo Y. J., Zhai B., J. Energ. Mater., 2015, 33(4), 305—314 |
| 74 | Han H. Z., Tsarevsky N. V., Chem. Sci., 2014, 5(12), 4599—4609 |
| 75 | Ayoup M. S., Cordes D. B., Slawin A. M. Z., O'Hagan D., Beilstein. J. Org. Chem., 2015, 11, 2671—2676 |
| 76 | Wang C. G., Chong A. M. L., Lu Y. P., Liu X., Goto A., Chem.⁃Eur. J., 2019, 25(56), 13025—13029 |
| 77 | Rui J. Y., Zhao Q., Huls A. J., Soler J., Paris J. C., Chen Z. H., Reshetnikov V., Yang Y. F., Guo Y. S., Garcia⁃Borras M., Huang X. Y., Nature, 2022, 376(6595), 869—874 |
| 78 | Gomez C. A., Mondal D., Du Q., Chan N., Lewis J. C., Angew. Chem. Int. Ed., 2023, 62(15), e202301370 |
| 79 | McHale K. S. S., Haines R. S., Harper J. B., ChemPlusChem, 2019, 84(5), 465—473 |
| 80 | McHale K. S. S., Wong M. J., Evans A. K., Gilbert A., Haines R. S., Harper J. B., Org. Biomol. Chem., 2019, 17(41), 9243—9250 |
| 81 | Xu X. D., Liu M. H., Yin Y., Zheng C. B., Deng P. Y., Xue D. F., Green Chem., 2016, 18(5), 1364—1367 |
| 82 | Meng G. Y., Guo T. J., Ma T. C., Zhang J., Shen Y. C., Sharpless K. B., Dong J. J., Nature, 2019, 574(7776), 86—89 |
| 83 | Liu Z., Liu J., Zhang L., Liao P., Song J., Bi X., Angew. Chem. Int. Ed., 2014, 53(21), 5305—5309 |
| 84 | Cao S. S., Ji Q. H., Li H. Z., Pang M. L., Yuan H. Y., Zhang J. P., Bi X. H., J. Am. Chem. Soc., 2020, 142(15), 7083—7091 |
| 85 | Liu H. X., Sun R. H., Ren C. W., Qiu X., Yang X. B., Jiang B., Org. Biomol. Chem., 2021, 19(1), 166—170 |
| 86 | Wang Y. K., Li L. B., Fu N. K., ACS Catal., 2022, 12(17), 10661—10667 |
| 87 | Weng Y. Y., Xu X. B., Chen H. T., Zhang Y. Y., Zhuo X. F., Angew. Chem. Int. Ed., 2022, 61(41), e202206308 |
| 88 | Liu S., Zhang L., Xu L., Gao P., Duan X. H., Guo L. N., Org. Lett., 2023, 25(8), 1336—1341 |
| 89 | Zhang C., Shao M. L., Wu D. Q., Li Z. Y., Zhao M. Z., Zhang X. F., Zhai B., Luo Y. J., Li X. Y., Angew. Chem. Int. Ed., 2023, 62(52), e202314052 |
| [1] | 李小六, 张宏波, 朱振刚, 陈华, 段科芳, 张平竹. 微波促进1,3-偶极环加成反应合成氮杂糖苷衍生物[J]. 高等学校化学学报, 2010, 31(9): 1791. |
| [2] | 肖勇军, 王建国, 刘幸海, 李永红, 李正名 . 基于受体结构的AHAS抑制剂的设计、合成及生物活性[J]. 高等学校化学学报, 2007, 28(7): 1280. |
| [3] | 张昉, 万颖, 李和兴 . 纳米介孔Ru-PPh2-SBA-16催化水相中高烯丙醇异构化反应的研究[J]. 高等学校化学学报, 2007, 28(1): 125. |
| [4] | 黄明智,谌伟民,黄可龙,黄路,杨光富 . FTIR监测7-氟-2H-1,4-苯并噁嗪-3(4H)-酮的固相合成[J]. 高等学校化学学报, 2006, 27(11): 2117. |
| [5] | 罗君涛, 黄文强. N-2-氯苄基苯甲酰胺的固相合成及其晶体结构分析[J]. 高等学校化学学报, 2004, 25(1): 56. |
| [6] | 陈凯, 杨华铮, 李永红. 新型原卟啉原氧化酶抑制剂的固相合成及生物活性研究[J]. 高等学校化学学报, 2001, 22(S1): 111. |
| [7] | 史真, 卢林刚, 王云侠. 龙葵醛的新合成方法研究[J]. 高等学校化学学报, 2001, 22(8): 1352. |
| [8] | 胡惟孝, 孙楠, 杨忠愚. 缩胺硫脲化合物的合成及其抗癌活性的研究[J]. 高等学校化学学报, 2001, 22(12): 2014. |
| [9] | 孙楠, 胡惟孝, 杨忠愚. 缩胺硫脲的合成及其抗癌活性的研究[J]. 高等学校化学学报, 1998, 19(S1): 304. |
| [10] | 周茂, 蔡志彬, 杨忠愚, 胡惟孝. 四嗪衍生物的合成及其抗癌性能研究[J]. 高等学校化学学报, 1998, 19(S1): 306. |
| [11] | 王进军, 韩光范, 尹荣, 姜贵吉. 7,10-二芳基-六氢(四氢)苯并[C]吖啶-8-酮的合成[J]. 高等学校化学学报, 1993, 14(6): 806. |
| [12] | 李朴, 师树简. 1,1′-二硒取代二茂铁衍生物的合成[J]. 高等学校化学学报, 1992, 13(6): 770. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||