

高等学校化学学报 ›› 2017, Vol. 38 ›› Issue (11): 1982.doi: 10.7503/cjcu20170063
唐乾1,2( ), 苏晋红2,3, 曹洪玉1,2, 王立皓2,3, 史飞2,3, 王爱玲2,3, 宫婷婷1, 金晓军2,3, 郑学仿2(
), 苏晋红2,3, 曹洪玉1,2, 王立皓2,3, 史飞2,3, 王爱玲2,3, 宫婷婷1, 金晓军2,3, 郑学仿2( )
)
收稿日期:2017-01-26
出版日期:2017-11-10
发布日期:2017-10-30
作者简介:联系人简介: 郑学仿, 男, 博士, 教授, 博士生导师, 主要从事无机生物化学研究. E-mail: 基金资助:
TANG Qian1,2,*( ), SU Jinhong2,3, CAO Hongyu1,2, WANG Lihao2,3, SHI Fei2,3, WANG Ailing2,3, GONG Tingting1, JIN Xiaojun2,3, ZHENG Xuefang2,*(
), SU Jinhong2,3, CAO Hongyu1,2, WANG Lihao2,3, SHI Fei2,3, WANG Ailing2,3, GONG Tingting1, JIN Xiaojun2,3, ZHENG Xuefang2,*( )
)
Received:2017-01-26
Online:2017-11-10
Published:2017-10-30
Contact:
TANG Qian,ZHENG Xuefang
E-mail:tangqian@dlu.edu.cn;dlxfzheng@126.com
Supported by:摘要:
在模拟生理条件下, 运用荧光光谱、 激光闪光光解(LFP)和分子对接等技术研究了8种具有抗肿瘤活性的嘧啶衍生物(PDs, 其中PDs A 5-FU为成药, PDs B-H为实验室自制)与人血清白蛋白(HSA)的相互作用. 利用Stern-Volmer方程和激光闪光光解技术分析了PDs对HSA的荧光猝灭机制, PDs A和B为静态猝灭, PDs G和H为动态猝灭. 用双倒数曲线法得出5种PDs与HSA的结合常数Ka和结合位点数n, 在测定条件下5种PDs与载体结合位点数均为1, 且均以弱结合力结合, 通过热力学参数ΔH, ΔS和ΔG推测出PDs B, C和E与HSA之间的作用力为静电作用力和疏水作用力, PDs A和D与HSA之间的作用力是氢键和范德华力, 分子对接结果与其一致. 根据Förster非辐射能量转移理论(FRET)分析了HSA和PDs之间的结合距离(r), 其结果均小于4 nm, 符合能量转移理论. 进一步利用同步荧光、 三维荧光和圆二色光谱考察了PDs与HSA结合过程中HSA空间构象的变化, 结果显示, 仅PDs A和C对HSA的芳香族氨基酸周围的疏水性略有增强作用. 体外实验结果表明, HSA可以作为优良的载体来运输和储存PDs A~E, 这为嘧啶衍生物的后续研究提供了可参考的实验数据.
中图分类号:
TrendMD:
唐乾, 苏晋红, 曹洪玉, 王立皓, 史飞, 王爱玲, 宫婷婷, 金晓军, 郑学仿. 嘧啶衍生物与人血清白蛋白的相互作用. 高等学校化学学报, 2017, 38(11): 1982.
TANG Qian, SU Jinhong, CAO Hongyu, WANG Lihao, SHI Fei, WANG Ailing, GONG Tingting, JIN Xiaojun, ZHENG Xuefang. Interaction of Pyrimidine Derivatives with Human Serum Albumin†. Chem. J. Chinese Universities, 2017, 38(11): 1982.
| PDs | IC50/(μmol·L-1) | PDs | IC50/(μmol·L-1) | ||
|---|---|---|---|---|---|
| HCC(7721) | MC(A375) | HCC(7721) | MC(A375) | ||
| A | 23.65 | 9.42 | E | 166.90 | 28.94 |
| B | 88.05 | 81.37 | F | 22.43 | 12.85 |
| C | 9.53 | 17.86 | G | 23.57 | 27.28 |
| D | 16.66 | 34.76 | H | 12.22 | 48.19 |
Table 1 IC50 values of the pyrimidine derivatives against tumor cells
| PDs | IC50/(μmol·L-1) | PDs | IC50/(μmol·L-1) | ||
|---|---|---|---|---|---|
| HCC(7721) | MC(A375) | HCC(7721) | MC(A375) | ||
| A | 23.65 | 9.42 | E | 166.90 | 28.94 |
| B | 88.05 | 81.37 | F | 22.43 | 12.85 |
| C | 9.53 | 17.86 | G | 23.57 | 27.28 |
| D | 16.66 | 34.76 | H | 12.22 | 48.19 |
| PDs | T/K | KSV/ (L·mol-1) | Kq/ (L·mol-1·s-1) | Quenching mechanism | PDs | T/K | KSV/ (L·mol-1) | Kq/ (L·mol-1·s-1) | Quenching mechanism |
|---|---|---|---|---|---|---|---|---|---|
| A | 300 | 3.206×104 | 3.20×1012 | Static quenching | E | 300 | 3.32×103 | 3.32×1011 | Static quenching |
| 310 | 3.17×104 | 3.17×1012 | 310 | 6.80×103 | 6.80×1011 | ||||
| 320 | 3.05×103 | 3.05×1012 | 320 | 6.12×103 | 6.12×1011 | ||||
| B | 300 | 7.05×103 | 7.05×1011 | Static quenching | F | 300 | 5.01×103 | 5.01×1011 | Dynamic quenching |
| 310 | 6.82×103 | 6.82×1011 | 310 | 3.32×103 | 3.32×1011 | ||||
| 320 | 6.36×103 | 6.36×1011 | 320 | 3.69×103 | 3.69×1011 | ||||
| C | 300 | 4.73×104 | 4.73×1012 | Static quenching | G | 300 | 4.91×103 | 4.91×1011 | Dynamic quenching |
| 310 | 4.34×104 | 4.34×1012 | 310 | 5.65×103 | 5.65×1011 | ||||
| 320 | 3.71×104 | 3.71×1012 | 320 | 6.60×103 | 6.60×1011 | ||||
| D | 300 | 4.76×103 | 4.76×1011 | Static quenching | H | 300 | 4.27×103 | 4.27×1011 | Dynamic quenching |
| 310 | 4.40×103 | 4.40×1011 | 310 | 4.42×103 | 4.42×1011 | ||||
| 320 | 4.20×103 | 4.20×1011 | 320 | 4.72×103 | 4.72×1011 |
Table 2 Stern-Volmer quenching constants(KSV), bimolecular quenching constants(Kq) and quenching mechanism
| PDs | T/K | KSV/ (L·mol-1) | Kq/ (L·mol-1·s-1) | Quenching mechanism | PDs | T/K | KSV/ (L·mol-1) | Kq/ (L·mol-1·s-1) | Quenching mechanism |
|---|---|---|---|---|---|---|---|---|---|
| A | 300 | 3.206×104 | 3.20×1012 | Static quenching | E | 300 | 3.32×103 | 3.32×1011 | Static quenching |
| 310 | 3.17×104 | 3.17×1012 | 310 | 6.80×103 | 6.80×1011 | ||||
| 320 | 3.05×103 | 3.05×1012 | 320 | 6.12×103 | 6.12×1011 | ||||
| B | 300 | 7.05×103 | 7.05×1011 | Static quenching | F | 300 | 5.01×103 | 5.01×1011 | Dynamic quenching |
| 310 | 6.82×103 | 6.82×1011 | 310 | 3.32×103 | 3.32×1011 | ||||
| 320 | 6.36×103 | 6.36×1011 | 320 | 3.69×103 | 3.69×1011 | ||||
| C | 300 | 4.73×104 | 4.73×1012 | Static quenching | G | 300 | 4.91×103 | 4.91×1011 | Dynamic quenching |
| 310 | 4.34×104 | 4.34×1012 | 310 | 5.65×103 | 5.65×1011 | ||||
| 320 | 3.71×104 | 3.71×1012 | 320 | 6.60×103 | 6.60×1011 | ||||
| D | 300 | 4.76×103 | 4.76×1011 | Static quenching | H | 300 | 4.27×103 | 4.27×1011 | Dynamic quenching |
| 310 | 4.40×103 | 4.40×1011 | 310 | 4.42×103 | 4.42×1011 | ||||
| 320 | 4.20×103 | 4.20×1011 | 320 | 4.72×103 | 4.72×1011 |
| Sample | τ1/ns | τ2/ns | B1 | B2 | τ/ns | χ2 | k2 | C2/(mol·L-1) |
|---|---|---|---|---|---|---|---|---|
| HSA | 2.24 | 6.62 | -0.30 | 0.81 | 7.25 | 1.13 | 1.51×105 | 1.59×10-6 |
| HSA+A | 2.18 | 6.61 | -0.37 | 0.95 | 7.26 | 1.25 | 1.51×105 | 1.64×10-6 |
| HSA+B | 2.22 | 6.52 | -0.38 | 0.97 | 7.18 | 0.97 | 1.53×105 | 1.64×10-6 |
| HSA+C | 2.06 | 5.58 | -0.24 | 0.59 | 6.20 | 1.02 | 1.79×105 | 1.69×10-6 |
| HSA+D | 2.26 | 6.62 | -0.39 | 0.96 | 7.32 | 1.26 | 1.51×105 | 1.68×10-6 |
| HSA+E | 1.92 | 5.92 | -0.26 | 0.72 | 6.45 | 0.69 | 1.69×105 | 1.57×10-6 |
| HSA+F | 1.89 | 6.00 | -0.36 | 1.05 | 6.50 | 1.69 | 1.67×105 | 1.52×10-6 |
| HSA+G | 2.00 | 5.83 | -0.43 | 1.07 | 6.44 | 1.25 | 1.72×105 | 1.67×10-6 |
| HSA+H | 2.05 | 6.09 | -0.52 | 1.29 | 6.72 | 1.80 | 1.64×105 | 1.68×10-6 |
Table 3 Fluorescent lifetime of HSA and HSA+PDs
| Sample | τ1/ns | τ2/ns | B1 | B2 | τ/ns | χ2 | k2 | C2/(mol·L-1) |
|---|---|---|---|---|---|---|---|---|
| HSA | 2.24 | 6.62 | -0.30 | 0.81 | 7.25 | 1.13 | 1.51×105 | 1.59×10-6 |
| HSA+A | 2.18 | 6.61 | -0.37 | 0.95 | 7.26 | 1.25 | 1.51×105 | 1.64×10-6 |
| HSA+B | 2.22 | 6.52 | -0.38 | 0.97 | 7.18 | 0.97 | 1.53×105 | 1.64×10-6 |
| HSA+C | 2.06 | 5.58 | -0.24 | 0.59 | 6.20 | 1.02 | 1.79×105 | 1.69×10-6 |
| HSA+D | 2.26 | 6.62 | -0.39 | 0.96 | 7.32 | 1.26 | 1.51×105 | 1.68×10-6 |
| HSA+E | 1.92 | 5.92 | -0.26 | 0.72 | 6.45 | 0.69 | 1.69×105 | 1.57×10-6 |
| HSA+F | 1.89 | 6.00 | -0.36 | 1.05 | 6.50 | 1.69 | 1.67×105 | 1.52×10-6 |
| HSA+G | 2.00 | 5.83 | -0.43 | 1.07 | 6.44 | 1.25 | 1.72×105 | 1.67×10-6 |
| HSA+H | 2.05 | 6.09 | -0.52 | 1.29 | 6.72 | 1.80 | 1.64×105 | 1.68×10-6 |
| Sample | F0/F | τ0/τ | Sample | F0/F | τ0/τ |
|---|---|---|---|---|---|
| HSA+A | 1.13 | 1.00 | HSA+E | 3.89 | 1.12 |
| HSA+B | 1.28 | 1.01 | HSA+F | 1.11 | 1.12 |
| HSA+C | 2.68 | 1.18 | HSA+G | 1.13 | 1.13 |
| HSA+D | 1.18 | 0.99 | HSA+H | 1.09 | 1.08 |
Table 4 Ratio of parameters of HSA+PDs
| Sample | F0/F | τ0/τ | Sample | F0/F | τ0/τ |
|---|---|---|---|---|---|
| HSA+A | 1.13 | 1.00 | HSA+E | 3.89 | 1.12 |
| HSA+B | 1.28 | 1.01 | HSA+F | 1.11 | 1.12 |
| HSA+C | 2.68 | 1.18 | HSA+G | 1.13 | 1.13 |
| HSA+D | 1.18 | 0.99 | HSA+H | 1.09 | 1.08 |
| PDs | T/K | Ka/(L·mol-1) | n | ΔH/(kJ·mol-1) | ΔS/(J·mol-1·K-1) | ΔG/(kJ·mol-1) | Interaction force |
|---|---|---|---|---|---|---|---|
| A | 300 | 3.41×103 | 1 | -6.62 | -45.6 | -20.3 | Hydrogen bond and Van der |
| 310 | 3.17×103 | 1.01 | -20.76 | Waals’ force | |||
| 320 | 2.89×103 | 1.02 | -21.23 | ||||
| B | 300 | 5.54×103 | 1.06 | -9.58 | 39.92 | -21.56 | Static electricity and |
| 310 | 5.22×103 | 1.06 | -21.96 | hydrophobic interaction | |||
| 320 | 4.37×103 | 1.09 | -22.35 | ||||
| C | 300 | 2.37×104 | 1.16 | -1.37 | 79.18 | -25.12 | Static electricity and |
| 310 | 2.33×104 | 1.15 | -25.92 | hydrophobic interaction | |||
| 320 | 2.29×104 | 1.11 | -26.71 | ||||
| D | 300 | 4.67×103 | 0.87 | -24.32 | -9.98 | -21.33 | Hydrogen bond and |
| 310 | 4.57×103 | 1.02 | -21.23 | Van der Waals’ force | |||
| 320 | 2.57×103 | 1.03 | -21.13 | ||||
| E | 300 | 1.17×105 | 0.86 | -32.18 | 9.78 | -29.25 | Static electricity and |
| 310 | 9.07×104 | 0.90 | -29.15 | hydrophobic interaction | |||
| 320 | 5.25×104 | 0.98 | -29.05 |
Table 5 Thermodynamic parameters of PDs-HSA binding process
| PDs | T/K | Ka/(L·mol-1) | n | ΔH/(kJ·mol-1) | ΔS/(J·mol-1·K-1) | ΔG/(kJ·mol-1) | Interaction force |
|---|---|---|---|---|---|---|---|
| A | 300 | 3.41×103 | 1 | -6.62 | -45.6 | -20.3 | Hydrogen bond and Van der |
| 310 | 3.17×103 | 1.01 | -20.76 | Waals’ force | |||
| 320 | 2.89×103 | 1.02 | -21.23 | ||||
| B | 300 | 5.54×103 | 1.06 | -9.58 | 39.92 | -21.56 | Static electricity and |
| 310 | 5.22×103 | 1.06 | -21.96 | hydrophobic interaction | |||
| 320 | 4.37×103 | 1.09 | -22.35 | ||||
| C | 300 | 2.37×104 | 1.16 | -1.37 | 79.18 | -25.12 | Static electricity and |
| 310 | 2.33×104 | 1.15 | -25.92 | hydrophobic interaction | |||
| 320 | 2.29×104 | 1.11 | -26.71 | ||||
| D | 300 | 4.67×103 | 0.87 | -24.32 | -9.98 | -21.33 | Hydrogen bond and |
| 310 | 4.57×103 | 1.02 | -21.23 | Van der Waals’ force | |||
| 320 | 2.57×103 | 1.03 | -21.13 | ||||
| E | 300 | 1.17×105 | 0.86 | -32.18 | 9.78 | -29.25 | Static electricity and |
| 310 | 9.07×104 | 0.90 | -29.15 | hydrophobic interaction | |||
| 320 | 5.25×104 | 0.98 | -29.05 |
| HSA+PDs | J/(cm3·L·mol-1) | R0/nm | E | r/nm |
|---|---|---|---|---|
| HSA+A | 1.55×10-14 | 2.64 | 0.12 | 3.68 |
| HSA+B | 1.43×10-14 | 2.60 | 0.22 | 3.21 |
| HSA+C | 2.95×10-14 | 2.94 | 0.65 | 2.65 |
| HSA+D | 1.41×10-14 | 2.60 | 0.16 | 3.42 |
| HSA+E | 2.54×10-14 | 2.86 | 0.74 | 2.41 |
Table 6 Energy transfer parameters between PDs and HSA
| HSA+PDs | J/(cm3·L·mol-1) | R0/nm | E | r/nm |
|---|---|---|---|---|
| HSA+A | 1.55×10-14 | 2.64 | 0.12 | 3.68 |
| HSA+B | 1.43×10-14 | 2.60 | 0.22 | 3.21 |
| HSA+C | 2.95×10-14 | 2.94 | 0.65 | 2.65 |
| HSA+D | 1.41×10-14 | 2.60 | 0.16 | 3.42 |
| HSA+E | 2.54×10-14 | 2.86 | 0.74 | 2.41 |
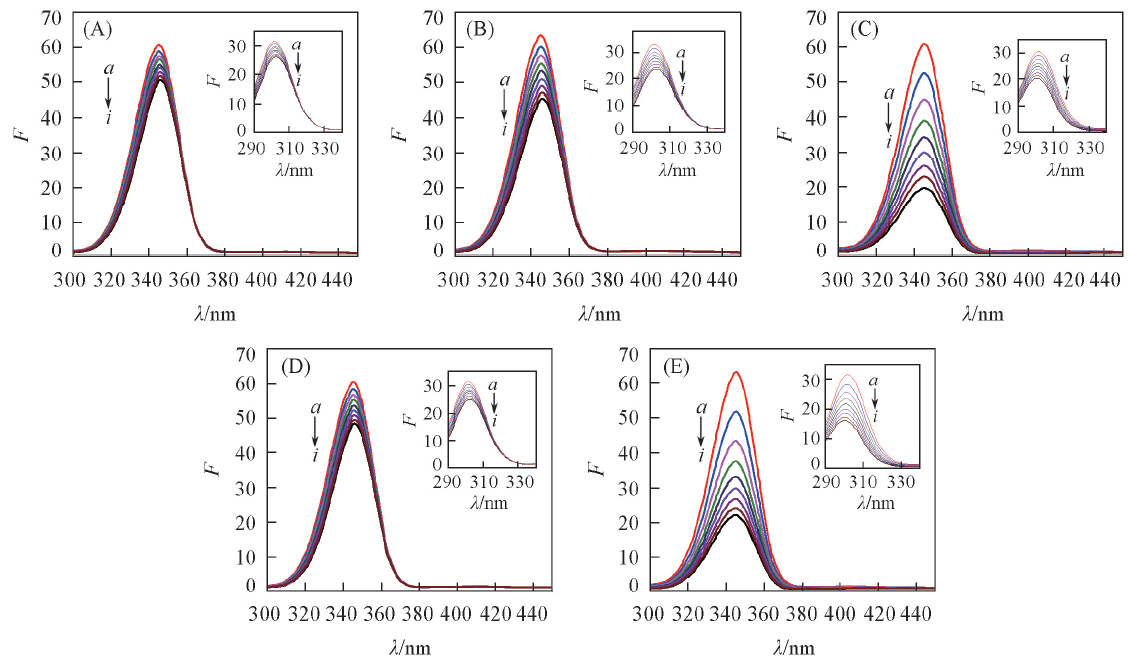
Fig.5 Synchronous fluorescent spectra showing the interaction between PDs and HSAc(HSA)=5 μmol/L, c(PDs)/(μmol·L-1) from a to i: 0, 5, 10, 15, 20, 25, 30, 35, 40.(A)—(E) PDs A—E, respectively, Δλ=60 nm; insets: Δλ=15 nm.
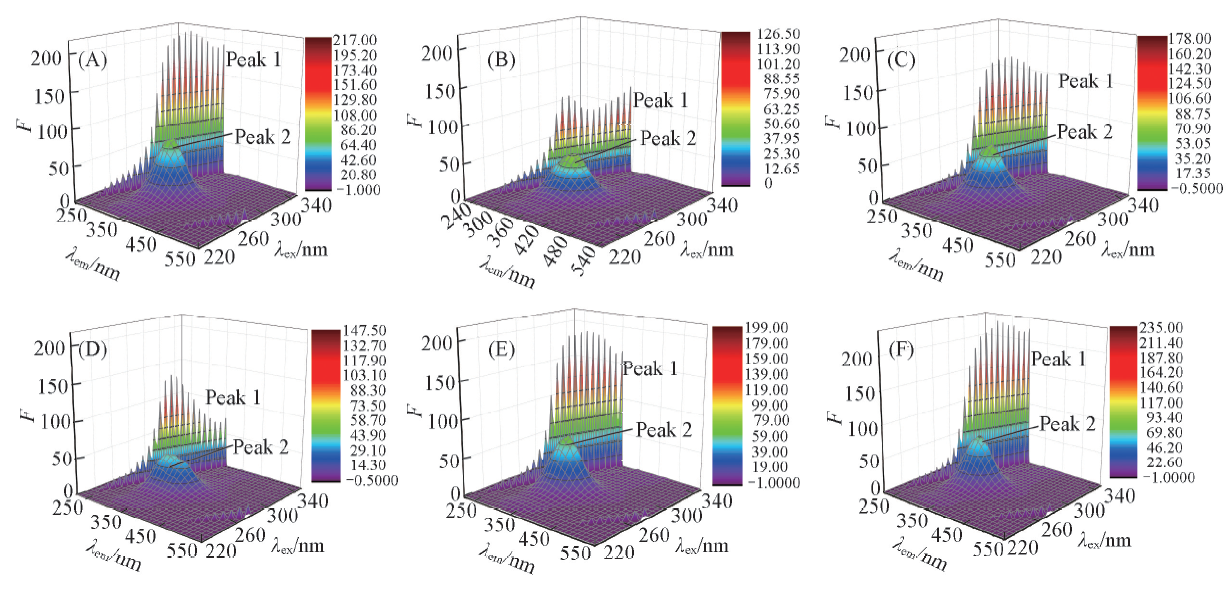
Fig.6 Three-dimensional fluorescence spectra of free HSA and the PDs-HSA systemc(HSA)=5 μmol/L, c(PDs)=20 μmol/L. (A) HSA; (B) HSA+A; (C) HSA+B; (D) HSA+C; (E) HSA+D; (F) HSA+E.
| System | Rayleigh scattering peak(Peak 1) | Fluorescence peak(Peak 2) | |||||
|---|---|---|---|---|---|---|---|
| Peak position λex/λem(nm/nm) | Stokes Δλ/nm | Fluorescence intensity | Peak position λex/λem(nm/nm) | Stokes Δλ/nm | Fluorescence intensity | ||
| HSA | 290/290 | 0 | 134.15 | 290/334 | 44 | 75.80 | |
| HSA+A | 290/290 | 0 | 100.69 | 290/338 | 48 | 51.63 | |
| HSA+B | 290/290 | 0 | 9.22 | 290/334 | 44 | 66.10 | |
| HSA+C | 290/290 | 0 | 112.33 | 290/328 | 38 | 41.25 | |
| HSA+D | 290/290 | 0 | 97.86 | 290/335 | 45 | 67.90 | |
| HSA+E | 290/290 | 0 | 125.45 | 290/335 | 45 | 71.71 | |
Table 7 Three-dimensional fluorescence spectral characteristics of HSA and HSA+PDs system
| System | Rayleigh scattering peak(Peak 1) | Fluorescence peak(Peak 2) | |||||
|---|---|---|---|---|---|---|---|
| Peak position λex/λem(nm/nm) | Stokes Δλ/nm | Fluorescence intensity | Peak position λex/λem(nm/nm) | Stokes Δλ/nm | Fluorescence intensity | ||
| HSA | 290/290 | 0 | 134.15 | 290/334 | 44 | 75.80 | |
| HSA+A | 290/290 | 0 | 100.69 | 290/338 | 48 | 51.63 | |
| HSA+B | 290/290 | 0 | 9.22 | 290/334 | 44 | 66.10 | |
| HSA+C | 290/290 | 0 | 112.33 | 290/328 | 38 | 41.25 | |
| HSA+D | 290/290 | 0 | 97.86 | 290/335 | 45 | 67.90 | |
| HSA+E | 290/290 | 0 | 125.45 | 290/335 | 45 | 71.71 | |
| [1] | Kratochwil N. A., Huber W., Muller F., Kansy M., Gerber P. R., Biochem. Pharmacol., 2002, 64(9), 1355-1374 |
| [2] | Ahmad B., Parveen S., Khan R. H., Biomacromolecules,2006, 7(4), 1350-1356 |
| [3] | Kelarakis A., Castelletto V., Krysmann M. J., Havredaki V., Viras K., Hamley I. W., Biomacromolecules,2008, 9(5), 1366-1371 |
| [4] | Ruiz J., Vicente C., de Haro C., Bautista D., Inorg. Chem., 2013, 52( 2), 974-982 |
| [5] | Han Y. C., Fan Y. R., Huang X., Wang Y. L., Chem. J. Chinese Universities,2010, 31(6), 1014-1023 |
| (韩玉淳, 樊艳茹, 黄旭, 王毅琳. 中国科学: 化学, 2014, 44(6), 1014-1023) | |
| [6] | Wen J. Y., Lü B. B., Zhang Y., Wang J. M., Ying X., Wang H., Ji L. N., Liu H. Y., Chem. J. Chinese Universities,2010, 31(6), 1033-1041 |
| (闻金燕, 吕标彪, 张阳, 王家敏, 应晓, 王慧, 计亮年, 刘海洋. 高等学校化学学报, 2015, 36(6), 1033-1041) | |
| [7] | Wang C., Wu Q. H., Wang Z., Zhao J., Anal. Sci., 2006, 22(3), 435-438 |
| [8] | Maciᶏzek-Jurczyk M., Sułkowska A., Bojko B., Równicka-Zubik J., Szkudlarek-Hasnik A., Zubik-Skupień I., Góra A., Dubas M., Korzonek-Szlacheta I., Wielkoszyński T., Zurawiński W., Sosada K., Spectrochim. Acta A Mol. Biomol. Spectrosc., 2012, 89(4), 270-275 |
| [9] | Maciᶏzek-Jurczyk M., Sułkowska A., Bojko B., Równicka-Zubik J., Sułkowski W. W., Spectrochim. Acta A Mol. Biomol. Spectrosc., 2011, 82(1), 189-190 |
| [10] | Gomha S. M., Zaki Y. H., Abdelhamid A. O., Molecules,2015, 20(12), 21826-21839 |
| [11] | Ghoneim K. M., El-Telbany F., Youssef K. M., J. Indian Chem. Soc., 1986, 63, 914-917 |
| [12] | Vishwas D., Suryawanshi Prashant V. A., Anil H. G., Shivajirao R. P., Govind B. K., J. Photochem. Photobiol. B: Biology,2013, 118, 1-8 |
| [13] | Zhao P. L., You W. W., Duan A. N., Chem. J. Chinese Universities,2010, 31(5), 580-587 |
| (赵培亮, 游文玮, 段安娜. 药学学报, 2012, 47(5), 580-587) | |
| [14] | Yasumoto M., Yamawaki I., Marunaka T., Hashimoto S., J. Med. Chem., 1978, 21(8), 738-741 |
| [15] | Masao T. A. D. A., Bull. Chem. Soc. Japan, 1975, 48(11), 3427-3428 |
| [16] | Mohammad H., RezaY., Asghar T. K., Farhad P., AliKhalafi N., Chem. J. Chinese Universities,2010, 31, 374-379 |
| [17] | Arica B., Calis S., Kas H., Sargon M., Hincal A., Int. J. Pharm., 2002, 242(1/2), 267-269 |
| [18] | Wang X. D., Chi G. C., Chen R. Y., Chin. J. Synth. Chem., 2001, 9(1), 1-2 |
| [19] | Rodgers K. R., Curr. Opin. Chem. Biol., 1999, 3(2), 158-167 |
| [20] | Seetharamappa J., Kamat B. P., Chem. Pharm. Bull., 2004, 52, 1053-1057 |
| [21] | Yang Y., Hu Q., Fan Y., Shen H., Chem. J. Chinese Universities,2010, 31(2), 432-436 |
| [22] | Kandagal P. B., Seetharamappa J., Ashoka S., Shaikh S. M., Manjunatha D. H., Int. J. Biol. Macromol., 2006, 39(4/5), 234-239 |
| [23] | Ray D., Paul B. K., Guchhait N., Chem. J. Chinese Universities,2010, 31, 18-27 |
| [24] | Sharma A. S., Ilanchelian M., Chem. J. Chinese Universities,2010, 31(30), 9461-9476 |
| [25] | Wei P., Fei D., Jiang Y. T., Peng Y. K., J. Agric. Food Chem., 2014, 62, 2271-2283 |
| [26] | Ganesh B. M., Shateesh B., Sudhir K., Santosh K. H., Chem. J. Chinese Universities,2010, 31, 20944-20950 |
| [27] | Shahabadi N., Khorshidi A., Moghadam N. H., Chem. J. Chinese Universities,2010, 31, 627-632 |
| [28] | Wang R., Wang X., Li Z., Xie Y., Yang L., Shi J., Chang J., Spectrochim Acta A: Mol. Biomol. Spectrosc., 2014, 132, 786-794 |
| [29] | Ma J., Zheng X.F., Tang Q., Yang Y. J., Sun X., Gao D. B.,Chem. J. Chinese Universities, 2008, 29(2), 258-263 |
| (马静, 郑学仿, 唐乾, 杨彦杰, 孙霞, 高大彬. 高等学校化学学报, 2008, 29(2), 258-263) | |
| [30] | Wang Y. Q., Zhang H. M., Zhang G. C., Liu S. X., Zhou Q. H., Fei Z. H., Liu Z. T., Int. J. Biol. Macromol., 2007, 41(3), 243-250 |
| [31] | Ross P. D., Subramanian S., Biochemistry,1981, 20(11), 3096-3102 |
| [32] | Bourassa P., Dubeau S., Maharvi G. M., Fauq A. H., Thomas T. J., Tajmir-Riahi H. A., Eur. J. Med. Chem., 2011, 46(9), 4344-4353 |
| [33] | Molina-Bolívar J. A., Galisteo-González C. R. F., Medina-O’ D. M., Parra A., J. Mol. Liq., 2015, 208, 304-313 |
| [34] | Xie X., Lü W., Chen X., J. Hazard. Mater., 2013, 248-249, 347-354 |
| [35] | Han X. L., Tian F. F., Ge Y. S, Jiang F. L., Lai L., Li D. W., Yu Q. L., Wang J., Lin C., Liu Y., Int. J. Biol. Macromol., 2012, 109, 1-11 |
| [36] | Li X., Li C., Jiang J. H., Gu H. W., Wei D. L., YE L. J., Hu J. L., Xiao S. X., Zhang H., Li X., Li Q. G., Chem. J. Chinese Universities,2010, 31(2), 166-171 |
| [37] | Maryam S., Hassan M. T., Ali Akbar S., J. Lumin., 2015, 167, 391-398 |
| [38] | Shen H., Gu Z., Jian K., Qi J., J. Pharm. Biomed. Anal., 2013, 75, 86-93 |
| [39] | Zhang J. L., Gu H. M., Zhang X. H., Carbohyd. Res., 2014, 384, 102-111 |
| [40] | Tu B., Wang Y., Mi R., Ouyang Y., Hu Y. J., Spectrochim Acta A: Mol. Biomol. Spectrosc., 2015, 149, 536-543 |
| [41] | Ge Y. S., Tai S. X., Xu Z. Q., Lai L., Tian F. F., Li D. W., Jiang F. L., Liu Y., Gao Z. N., Langmuir,2012, 28, 5913-5920 |
| [42] | Cheng H., Liu H., Zhang Y., J. Lumin., 2009, 129, 1196-1203 |
| [43] | Nicolott O., Catto M., Giangreco I., Eur. J. Med. Chem., 2012, 58, 368-376 |
| [1] | 李梦硕, 张静, 刘丹, 朱亚先, 张勇. 芘与人血清白蛋白和牛血清白蛋白结合位点微环境极性的差异[J]. 高等学校化学学报, 2021, 42(3): 731. |
| [2] | 张爱芹, 王嫚, 申刚义, 金军. 多溴联苯醚与人血清白蛋白相互作用的表面等离子体共振及分子对接[J]. 高等学校化学学报, 2020, 41(9): 2054. |
| [3] | 崔胜峰, 万敬伟, 周成合. 地西泮与乙醇协同作用机制的荧光光谱分析[J]. 高等学校化学学报, 2018, 39(6): 1178. |
| [4] | 杨美玲, 秦冬冬, 宋玉民. 稀土华法林阿魏酸三元配合物的制备及抗凝血作用[J]. 高等学校化学学报, 2015, 36(5): 821. |
| [5] | 董露, 易忠胜, 伍智蔚, 王海洋, 张爱茜. 2'-羟基-2,4-二溴二苯醚与人血清白蛋白作用机制的光谱研究与计算模拟[J]. 高等学校化学学报, 2015, 36(3): 516. |
| [6] | 朱洪彬, 刘舒, 王春艳, 刘志强, 宋凤瑞. 离心超滤质谱筛选川乌中与人血清白蛋白相互作用的乌头类生物碱[J]. 高等学校化学学报, 2013, 34(7): 1635. |
| [7] | 王宁 刘忠英 胡秀丽 卜凤泉 赵学忠. 黄芩类药物与人血清白蛋白相互作用的研究[J]. 高等学校化学学报, 2011, 32(2): 241. |
| [8] | 张巍, 赵雨, 白雪媛, 惠歌, 赵大庆, 赵冰1. 黄芩素和黄芩苷与人血清白蛋白相互作用的光谱研究[J]. 高等学校化学学报, 2010, 31(9): 1834. |
| [9] | 张亚东, 庞燕, 陆洁, 魏晓焱, 杨文江, 朱美霖. 叶酸受体靶向的人血清白蛋白-叶酸偶联物的制备、标记及生物性能评价[J]. 高等学校化学学报, 2010, 31(10): 1999. |
| [10] | 刘淑芳, 尹俊发, 宋茂勇, 汪海林. 水溶性羟基化单壁碳纳米管与人血清白蛋白之间的相互作用研究[J]. 高等学校化学学报, 2009, 30(9): 1733. |
| [11] | 马萍, 迟燕华, 庄稼, 王晗, 陈亮, 柳旭, 董发勤. 骨螺紫及其铜配合物与人血清白蛋白相互作用的光谱学研究[J]. 高等学校化学学报, 2009, 30(8): 1509. |
| [12] | 熊兴良, 蔡绍皙, 李苑. 利用液晶取向变化的光学免疫检测方法[J]. 高等学校化学学报, 2009, 30(5): 891. |
| [13] | 王丛霞, 叶玲, 闫芳菲, 王楠, 余沛霖. 利福布汀与人血清白蛋白相互作用的光谱研究[J]. 高等学校化学学报, 2007, 28(12): 2280. |
| [14] | 杨曼曼 席小莉 杨频. 用荧光猝灭和荧光加强两种理论研究喹诺酮类新药与白蛋白的作用[J]. 高等学校化学学报, 2006, 27(4): 687. |
| [15] | 王学亮, 孙伟, 焦奎, 张魁堂. 以溴甲酚紫为电化学探针测定血清白蛋白[J]. 高等学校化学学报, 2004, 25(8): 1448. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||