Scheme 1
Synthetic route of PVA⁃CS⁃c ⁃t composite hydrogel
Fig.1
FTIR spectra of PVA⁃CS(a ) and PVA⁃CS⁃6.16⁃30(b ) hydrogels
Fig.2
Mechanical performances of PVA⁃CS(a ) and PVA⁃CS⁃6.16⁃30(b ) hydrogels
(A, B) Tensile(A) and compressive stress⁃strain curves(B) of PVA⁃CS and PVA⁃CS⁃6.16⁃30 hydrogels; (C) stress⁃time plot of PVA⁃CS⁃6.16⁃30 hydrogel during 10 times of consecutive compressions; (D) creep and recovery curves of PVA⁃CS and PVA⁃CS⁃6.16⁃30 hydrogels.
Fig.3
Stress⁃strain curves of PVA⁃CS⁃c ⁃t hydrogels as a function of NaCl concentrations(A) and soaking time(B)
Fig.4
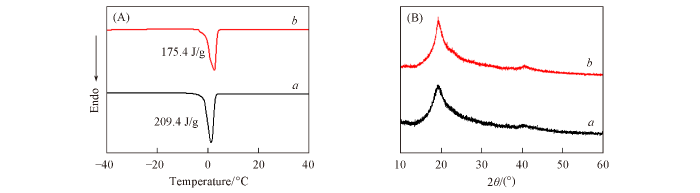
DSC heating curves(A) and XRD patterns(B) of PVA⁃CS(a ) and PVA⁃CS⁃6.16⁃30(b ) hydrogels
Fig.5
SEM images of PVA⁃CS(A) and PVA⁃CS⁃6.16⁃30(B) hydrogels
Fig.6
Loading⁃unloading curves of PVA⁃CS and PVA⁃CS⁃6.16⁃30 hydrogels(A) and cyclic loading curves of the PVA⁃CS⁃6.16⁃30 hydrogel under different strains(B)
Fig.7
Results of rheology experiments of PVA⁃CS and PVA⁃CS⁃6.16⁃30 hydrogels
(A) Strain sweep measurements performed at a fixed frequency(6.28 rad/s); (B) temperature sweep measurements conducted at the constant frequency(6.28 rad/s) and strain(0.5%).
Fig.8
Swelling properties of PVA⁃CS and PVA⁃CS⁃6.16⁃30 hydrogels
(A) Swelling curves of PVA⁃CS and PVA⁃CS⁃6.16⁃30 hydrogels in water; (B) images of PVA⁃CS and PVA⁃CS⁃6.16⁃30 hydrogels before and after soaking in DI water for 12 h; (C, D) tensile(C) and compressive stress⁃strain(D) curves of swollen samples.
Fig.9
Images of PVA⁃CS⁃6.16⁃30 hydrogel after soa⁃king in PBS aqueous solution at 37 ℃ for 7 d
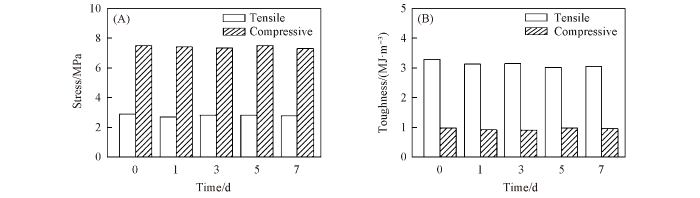
Fig.10
Stress(A) and toughness(B) of the swollen PVA⁃CS⁃6.16⁃30 hydrogel in PBS aqeous solution at 37 ℃ at different soaking time
[1]
Fan H. L., Gong J. P., Macromolecules , 2020 , 53 (8), 2769—2782
[本文引用: 2]
[2]
Yan H., Tang P., Li S. H., Zhao T. Y., Liu M. J., Chem. J. Chinese Universities , 2020 , 41(5), 936—946 (严昊, 唐萍, 李书宏, 赵天艺, 刘明杰. 高等学校化学学报, 2020 , 41 (5), 936—946)
[3]
Sun G. D., Pan X. P., Zhong Y. H., Chen E. Y., Huang Y., Shao J. Z., Chem. J. Chinese Universities , 2019 , 40(11), 2404—2411 (孙广东, 潘小鹏, 钟宇浩, 陈恩宇, 黄益, 邵建中. 高等学校化学学报, 2019 , 40 (11), 2404—2411)
[4]
Li J., Mo L. T., Lu C. H., Fu T., Yang H. H., Tan W. H., Chem. Soc. Rev. , 2016 , 45 (5), 1410—1431
[5]
Thiele J., Ma Y. J., Bruekers S. M. C., Ma S. H., Huck W. T. S., Adv. Mater. , 2014 , 26 (1), 125—148
[本文引用: 1]
[6]
Wang T., Gunasekaran S., J. Appl. Polym. Sci. , 2006 , 101 (5), 3227—3232
[本文引用: 7]
[7]
Gong J. P., Soft Matter , 2010 , 6 (12), 2583—2590
[本文引用: 2]
[8]
Cipriano B. H., Banik S. J., Sharma R., Rumore D., Hwang W., Briber R. M., Raghavan S. R., Macromolecules , 2014 , 47 (13), 4445—4452
[本文引用: 2]
[9]
Means A. K., Grunlan M. A., ACS Macro Lett. , 2019 , 8 (6), 705—713
[本文引用: 1]
[10]
Kamata H., Akagi Y., Kayasuga⁃Kariya Y., Chung U. I., Sakai T., Science , 2014 , 343 (6173), 873—875
[本文引用: 2]
[11]
Qin Z. Z., Yu X. F., Wu H. Y., Li J. G., Lv H. Y., Yang X. N., Biomacromolecules , 2019 , 20 (9), 3399—3407
[本文引用: 4]
[12]
Wang J. S., Xiao W. W., Zhong Y. S., Li X. D., Du S. X., Xie P., Zheng G. Z., Han J. M., J. Cell Biochem , 2019 , 120 (6), 10195—10204
[本文引用: 1]
[13]
Zhang H. J., Sun T. L., Zhang A. K., Ikura Y., Nakajima T., Nonoyama T., Kurokawa T., Ito O., Ishitobi H., Gong J. P., Adv. Mater. , 2016 , 28 (24), 4884—4890
[14]
Seng H., Xu B., Qin M., Wang W., Cao Y., Chem. J. Chinese Universities , 2020 , 41 (6), 1194—1207 (盛卉,薛斌, 秦猛, 王炜, 曹毅. 高等学校化学学报, 2020 , 41 (6), 1194—1207)
[本文引用: 1]
[15]
Rafique A., Zia M. K., Zuber M., Tabasum S., Rehman S., Int. J. Biol. Macromol , 2016 , 87 , 141—154
[本文引用: 1]
[16]
Yang Y. Y., Wang X., Yang F., Shen H., Wu D. C., Adv. Mater. , 2016 , 28 (33), 7178—7184
[本文引用: 8]
[17]
Kupiec T. C., Goldenring J. M., Raj V., J. Anal. Toxicol. , 2004 , 28 (6), 526—528
[本文引用: 3]
[18]
Hassan C. M., Peppas N. A., Adv. Polym. Sci. , 2000 , 153 , 37—65
[本文引用: 3]
[19]
Kumar M. N. V. R., React. Funct. Polym. ,2000 , (46), 1—27
[本文引用: 3]
[20]
Song G. S., Zhao Z. Y., Peng X., He C. C., Weiss R. A., Wang H. L., Macromolecules , 2016 , 49 (21), 8265—8273
[本文引用: 3]
[21]
Holloway J. L., Lowman A. M., Palmese G. R., Soft Matter , 2013, 9(3), 826—833
[本文引用: 7]
[22]
Liu J., Zhou H., Huang Y. F., Chen X., Chem. J. Chinese Universities , 2018 , 39 (3), 591—597 (刘杰, 周浩, 黄郁芳, 陈新. 高等学校化学学报, 2018 , 39 (3), 591—597)
[本文引用: 1]
[23]
Niknia N., Kadkhodaee R., Carbohydr. Polym. , 2017 , 155 , 475—482
[本文引用: 1]
[24]
Chen Q., Zhu L., Zhao C., Wang Q. M., Zheng J., Adv. Mater. , 2013 , 25 (30), 4171—4176
[本文引用: 1]
[25]
Sun X. X., Luo C. H., Luo F. L., Eur. Polym. J. , 2020 , 124 , 109465
[本文引用: 2]
[26]
Yang Y. Y., Wang X., Yang F., Wang L. N., Wu D. C., Adv. Mater. , 2018 , 30 (18), e1707071
[本文引用: 5]
[27]
He Q. Y., Huang Y., Wang S. Y., Adv. Funct. Mater. , 2018 , 28 (5), 1705069
[本文引用: 1]
[28]
Thanyacharoen T., Chuysinuanb P., Techasakul S., Nooeaid P., Ummartyotina S., Int. J. Biol. Macromol. , 2018 , 107 , 363—370
[本文引用: 1]
[29]
Fan L. H., Yang H., Yang J., Peng M., Hu J., Carbohydr. Polym. , 2016 , 146 , 427—434
[本文引用: 1]
[30]
Pretsch E., Bühlmann P., Badertscher M., Structure Determination of Organic Compounds , Springer⁃Verlag Berlin, Heidelberg, 2000 , 287
[本文引用: 6]
[31]
Bai R. B., Yang J. W., Suo Z. G., Eur. J. Mech. A ⁃Solid , 2019 , 74 , 337—370
[本文引用: 2]
[32]
Gao H. W., Yang R. J., He J. Y., Yang L., Acta Polym. Sin. , 2010 , 1 (2), 542—549(高瀚文, 杨荣杰, 何吉宇, 杨磊. 高分子学报, 2010 , 1 (2), 542—549)
[本文引用: 1]
[33]
Xiang X. T., Chen G. Q., Chen K., Jiang X. C, Hou L. X., Int. J. Biol. Macromol. , 2020 , 142 , 574—582
[本文引用: 3]
[34]
Fu J., Yang F. C., Guo Z. G., New J. Chem. , 2018 , 42 (21), 17162—17180
[本文引用: 2]
[35]
Jiang X. C., Xiang N. P., Zhang H. X., Sun Y. J., Lin Z., Hou L. X., Carbohydr. Polym. , 2018 , 186 , 377—383
[本文引用: 1]
[36]
Ricciardi R., D'Errico G., Auriemma F., Ducouret G., Tedeschi A. M., Rosa C. D., Lauprêtre F., Lafuma F., Macromolecules , 2005 , 38 (15), 6629—6639
[本文引用: 1]
[37]
Luo C. H., Wei N., Sun X. X., Luo F. L., J. Appl. Polym. Sci. , 2020 , 137 (37), 49118
[本文引用: 1]
[38]
Wang W., Zhang Y. Y., Liu W. G., Prog. Polym. Sci. , 2017 , 71 , 1—25
[本文引用: 1]
[39]
Pincus P., Macromolecules , 1991 , 24 , 2912—2919
[本文引用: 1]
[40]
Kyriazis A., Aubry T., Burchard W., Tsitsilianis C., Polymer , 2009 , 50 (14), 3204—3210
[本文引用: 1]
[41]
Fan H., Wang J., Jin Z., Macromolecules , 2018 , 51 (5), 1696—1705
[本文引用: 1]
[42]
Gao Y., Gu S., Jia F., Gao G. H., J. Mater. Chem. A , 2020 , 8 (45), 24175—24183
[本文引用: 1]
2
... 水凝胶材料含水量高, 生物相容性良好, 且兼具固体的支持性以及液体的传递性优点, 在组织工程和生物医药领域具有广泛的应用前景[1 ~5 ] . 传统水凝胶由于交联方式单一且网络结构不均匀, 机械性能较差. 例如, 壳聚糖(CS)是常用的生物医用材料, 但戊二醛交联的CS水凝胶强度在千帕范围[6 ] . 在CS水凝胶中引入聚丙烯酰胺(PAM)网络可以提高其强度, 但残余AM单体也存在安全隐患[7 ] . 尽管透析可以除去这些物质, 但是大多数水凝胶遇水体积膨胀[8 ] , 不仅会使其强度劣化, 还会损害周围细胞. 因此, 构筑综合性能优异的水凝胶是组织工程领域的难题. ...
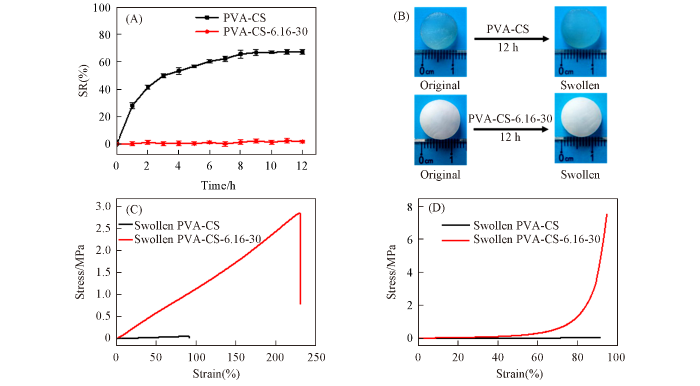
... 由于亲水性侧链以及网络通道的存在, 大部分水凝胶遇水膨胀, 极大限制了其实际应用[1 ,8 ,37 ] . 因此, 借鉴文献[11 ]方法评价了其抗溶胀特性. 由图8 (A)可见, 室温下PVA-CS和PVA-CS-6.16-30两种水凝胶在去离子水中浸泡12 h后, 溶胀度分别为67%和0. 同时, PVA-CS水凝胶的直径由10 mm增加至13 mm, 而PVA-CS-6.16-30的直径几乎不变[图8 (B)]. 由图8 (C)和(D)可见, PVA-CS在去离子水中溶胀平衡后其抗拉强度和断裂伸长率分别衰减至0.05 MPa和90%, 与文献报道值接近[33 ] . 而处于溶胀平衡状态的PVA-CS-6.16-30水凝胶的抗拉和抗压强度依然分别高达2.8和7.5 MPa, 远高于常见抗溶胀水凝胶在千帕范围的抗拉强度[10 ,11 ] , 也优于大多数物理交联水凝胶[38 ] . 因为传统水凝胶内部渗透压高于外部水溶液[39 ,40 ] , 而且其多孔结构有利于水分子扩散, 所以遇水后体积显著膨胀. 而PVA-CS-6.16-30水凝胶中的PVA链在形成结晶微区时处于预拉伸状态, 构象熵较低[41 ] , 而非共价键的协同交联作用进一步降低了网络缺陷[16 ] , 因此具有优异的耐溶胀性能. 将1.0 g PVA-CS-6.16-30水凝胶在100 mL去离子水中浸泡2 d后测得水溶液电导率为1.323 μS/cm, 而去离子水的电导率为1.320 μS/cm(表S1, 见本文支持信息). 根据氯化钠浓度与电导率的标准曲线(y =0.6312x +0.01)计算可知, NaCl残余量为0.012 mg/kg, 远低于205(mmol/kg成人体重)的临界安全浓度[17 ] . Yang等[26 ] 制备的PAM/CS水凝胶及Gao等[42 ] 构筑的PVA/NaCl水凝胶(NaCl含量为78.3 g/kg水凝胶)的生物相容性均已得到细胞实验证实. 考虑到CS和PVA的安全性已经得到FDA认证, 且PVA-CS-6.16-30水凝胶中NaCl含量远低于临界安全浓度, 说明该水凝胶具有较好的生物相容性. 进一步评价了PVA-CS-6.16-30水凝胶在生理环境中的耐溶胀性. 将圆柱形水凝胶在37 ℃的PBS(pH=7.4, c =0.01 mol/L)中浸泡7 d后观察其形状并评价机械性能. 由图9 和图10 可见, 浸泡7 d后该水凝胶初始形状保持不变, 且浸泡过程中样品的抗拉和抗压强度几乎与浸泡前相同, 明显优于常见PVA/CS复合水凝胶体系(表S2, 见本文支持信息). ...
1
... 水凝胶材料含水量高, 生物相容性良好, 且兼具固体的支持性以及液体的传递性优点, 在组织工程和生物医药领域具有广泛的应用前景[1 ~5 ] . 传统水凝胶由于交联方式单一且网络结构不均匀, 机械性能较差. 例如, 壳聚糖(CS)是常用的生物医用材料, 但戊二醛交联的CS水凝胶强度在千帕范围[6 ] . 在CS水凝胶中引入聚丙烯酰胺(PAM)网络可以提高其强度, 但残余AM单体也存在安全隐患[7 ] . 尽管透析可以除去这些物质, 但是大多数水凝胶遇水体积膨胀[8 ] , 不仅会使其强度劣化, 还会损害周围细胞. 因此, 构筑综合性能优异的水凝胶是组织工程领域的难题. ...
7
... 水凝胶材料含水量高, 生物相容性良好, 且兼具固体的支持性以及液体的传递性优点, 在组织工程和生物医药领域具有广泛的应用前景[1 ~5 ] . 传统水凝胶由于交联方式单一且网络结构不均匀, 机械性能较差. 例如, 壳聚糖(CS)是常用的生物医用材料, 但戊二醛交联的CS水凝胶强度在千帕范围[6 ] . 在CS水凝胶中引入聚丙烯酰胺(PAM)网络可以提高其强度, 但残余AM单体也存在安全隐患[7 ] . 尽管透析可以除去这些物质, 但是大多数水凝胶遇水体积膨胀[8 ] , 不仅会使其强度劣化, 还会损害周围细胞. 因此, 构筑综合性能优异的水凝胶是组织工程领域的难题. ...
... 采用称重法, 根据下式计算水凝胶中水的质量分数(X TW , %)[6 ] : ...
... 水凝胶中自由水(X FW , %)以及结合水(X BW , %)的质量分数根据下式计算[6 ] : ...
... 式中: Q endo (J/g)和Q f (J/g)分别为样品的熔融焓与纯水的熔融焓(333.5 J/g[6 ] ). ...
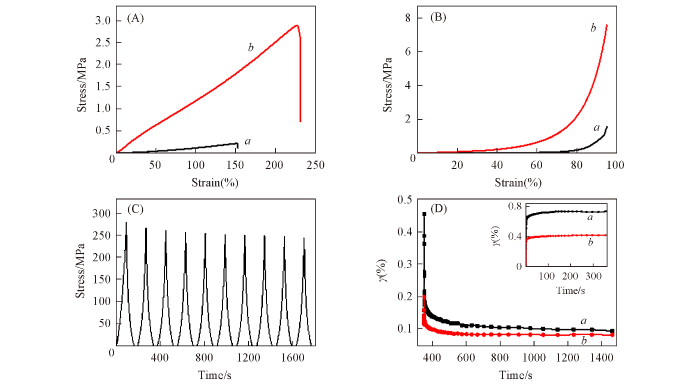
... CS的溶解性与溶液pH值及离子强度有关[16 ] . 例如, Yang等[26 ] 将PAM/CS水凝胶在柠檬酸钠水溶液中浸泡后, 其抗拉强度由0.15 MPa提高到了5.6 MPa. 由于NaCl也是一种具有霍夫曼效应的盐[30 ] , 而PVA/CS复合水凝胶机械性能欠佳[6 ] , 因此采用NaCl水溶液浸泡的方法来提高水凝胶的机械性能. 图S2(见本文支持信息)表明, 当PVA与CS的质量比为100∶5时, 前驱体水凝胶的机械性能最佳. 其 抗拉强度、 断裂伸长率、 拉伸模量、 韧性和抗压强度分别为0.22 MPa, 152%, 0.027 MPa, 0.13 MJ/m3 [图2 (A)]和1.5 MPa[图2 (B)]. 而复合水凝胶PVA-CS-6.16-30的抗拉强度、 断裂伸长率、 拉伸模量、 韧性和抗压强度显著提高至2.9 MPa, 229%, 1.13 MPa, 3.3 MJ/m3 [图2 (A)]和7.6 MPa[图2 (B)]. 此外, 该复合水凝胶还具有优异的抗疲劳特性, 连续压缩10次后其抗压强度依然为初始值的85%[图2 (C)]. 低于100%的可能原因是氢键、 结晶微区及链缠结等交联点的可逆断裂与重组具有依时性[31 ] . 同时, 复合水凝胶PVA-CS-6.16-30还具有良好的抗蠕变性能, 相同作用力下其形变仅为0.42%, 而PVA-CS的形变为0.74%[图2 (D)插图]. 此外, 复合水凝胶PVA-CS-6.16-30的柔量为3.1×10‒5 Pa‒1 , 仅为PVA-CS的10%[图2 (D)], 说明该复合水凝胶具有良好的抗蠕变性能[32 ] . 上述实验证明在NaCl水溶液中浸泡后前驱体水凝胶PVA-CS的机械性能得到了极大的提升. ...
... 结合DSC、 XRD、 SEM及流变分析揭示了水凝胶的微观结构. 首先, 利用DSC[6 ] 测试了PVA-CS和PVA-CS-6.16-30水凝胶中自由水与结合水的含量[图4 (A)]. PVA-CS在1.5 ℃处出现了自由水的吸热峰[6 ] , 其熔融焓为209.4 J/g, 由式(2) 可计算出自由水质量分数为62.8%, 由总含水量(89.1%)减去自由水含量可知结合水含量为26.3%. 而PVA-CS-6.16-30中自由水的熔融焓降低至175.4 J/g, 由式(2) 可知自由水含量为52.6%. 由总含水量(81.9%)减去自由水含量可知结合水含量为 29.3%. 通常自由水含量降低, 水凝胶内摩擦阻力增加[35 ] . 采用XRD分析了原料PVA与CS的结晶度(图S4, 见本文支持信息). 可见, 原料CS没有明显衍射峰, 说明CS粉末中不存在晶体结构[16 ] ; 而PVA粉末在2θ 值为19.6°处出现了较强的特征衍射峰, 对应PVA的(101)晶面[21 ] . 由2θ 值为18°~21°之间的积分面积(1284.9)除以衍射曲线下方总面积(8988.3), 利用式(3) 可计算出PVA粉末的结晶度等于14.3%. 进一步利用XRD分析了后处理对水凝胶中PVA结晶度的影响. 由图4 (B)可见, 两种水凝胶在2θ 值为 18°~21°之间均出现了PVA的(101)晶面的特征衍射峰[21 ] , 利用式(3) 可计算出PVA结晶度. 结果表明, 后处理使PVA结晶度由14.8%增加至17.2%[21 ] . 这是因为NaCl浸泡过程中水凝胶体积收缩, PVA排列更紧密, 有利于结晶[21 ] . 通常, 自由含水率下降, 结晶度增加, 材料机械性能会提高[18 ] . ...
... [6 ], 其熔融焓为209.4 J/g, 由式(2) 可计算出自由水质量分数为62.8%, 由总含水量(89.1%)减去自由水含量可知结合水含量为26.3%. 而PVA-CS-6.16-30中自由水的熔融焓降低至175.4 J/g, 由式(2) 可知自由水含量为52.6%. 由总含水量(81.9%)减去自由水含量可知结合水含量为 29.3%. 通常自由水含量降低, 水凝胶内摩擦阻力增加[35 ] . 采用XRD分析了原料PVA与CS的结晶度(图S4, 见本文支持信息). 可见, 原料CS没有明显衍射峰, 说明CS粉末中不存在晶体结构[16 ] ; 而PVA粉末在2θ 值为19.6°处出现了较强的特征衍射峰, 对应PVA的(101)晶面[21 ] . 由2θ 值为18°~21°之间的积分面积(1284.9)除以衍射曲线下方总面积(8988.3), 利用式(3) 可计算出PVA粉末的结晶度等于14.3%. 进一步利用XRD分析了后处理对水凝胶中PVA结晶度的影响. 由图4 (B)可见, 两种水凝胶在2θ 值为 18°~21°之间均出现了PVA的(101)晶面的特征衍射峰[21 ] , 利用式(3) 可计算出PVA结晶度. 结果表明, 后处理使PVA结晶度由14.8%增加至17.2%[21 ] . 这是因为NaCl浸泡过程中水凝胶体积收缩, PVA排列更紧密, 有利于结晶[21 ] . 通常, 自由含水率下降, 结晶度增加, 材料机械性能会提高[18 ] . ...
2
... 水凝胶材料含水量高, 生物相容性良好, 且兼具固体的支持性以及液体的传递性优点, 在组织工程和生物医药领域具有广泛的应用前景[1 ~5 ] . 传统水凝胶由于交联方式单一且网络结构不均匀, 机械性能较差. 例如, 壳聚糖(CS)是常用的生物医用材料, 但戊二醛交联的CS水凝胶强度在千帕范围[6 ] . 在CS水凝胶中引入聚丙烯酰胺(PAM)网络可以提高其强度, 但残余AM单体也存在安全隐患[7 ] . 尽管透析可以除去这些物质, 但是大多数水凝胶遇水体积膨胀[8 ] , 不仅会使其强度劣化, 还会损害周围细胞. 因此, 构筑综合性能优异的水凝胶是组织工程领域的难题. ...
... 综合上述实验提出如下增强机理: PVA链在冻-融循环中形成的结晶微区构成了水凝胶的初级交联点. 由于冻-融循环时结晶微区无序形成和生长, 且不具备高效的能量耗散机制[36 ] , 所以单网络PVA水凝胶的抗拉强度仅为0.15 MPa. 而借鉴双网络设计理念[7 ] 在PVA水溶液中加入少量CS(5%), 可将前驱体水凝胶PVA-CS的抗拉强度增加至0.22 MPa(图S2, 见本文支持信息). 由于PVA与CS之间的氢键较强, 有利于CS分子链均匀分布在黏性PVA三维网络中. 当在高浓度NaCl水溶液中浸泡时, 由于渗透压作用, 水凝胶体积收缩, 使PVA结晶度由14.8%增加至17.2%, 同时含水率由89.1%降低至81.9%. 尤为重要的是, Cl- 的霍夫曼效应降低了PVA和CS与水分子之间的相互作用, 增加了聚合物/水界面的界面张力[30 ] , 导致大分子链水溶性降低, 从而沉淀在样品瓶底部(Scheme 1 ). 水凝胶三维网络的受限空间抑制了宏观相分离的发生 [30 ] , 因此CS链在凝胶网络内形成链缠结疏水微区[16 ] . 由于CS链缠结微区在非酸性水溶液中十分稳定[19 ] , 将盐水替换为去离子水并搅拌后CS溶液依然浑浊(图S5, 见本文支持信息). 因此, 用去离子水透析2 d除去残余NaCl时大部分CS链依然以链缠结微区形式充当交联点[16 ] , 而PVA的水合作用使水凝胶体积增加至透析前的1.24倍(图S6, 见本文支持信息). 上述作用增加了水凝胶交联密度, 并有效减少了端链、 无效交联点及封闭的链段等网络缺陷. 与PVA-CS水凝胶相比, PVA-CS-6.16-30水凝胶的交联密度由7.69×10-4 mol/cm3 增加至9.97×10-4 mol/cm3 , 网孔尺寸由 6.11 nm降低至5.21 nm, 凝胶分数由58.6%增加至86.8%, 网络均匀性和致密性提高. 此外, 自由水含量由62.8%降低至52.6%, 水凝胶内摩擦力和黏弹性增加. 而氢键和疏水微区等非共价键在外力下的可逆断裂与重组耗散了大量能量, 使PVA-CS-6.16-30水凝胶的抗拉强度显著增加至2.9 MPa. 由于PVA结晶微区融化温度在70 ℃附近[18 ] , 而CS链缠结微区在非酸性水溶液中十分稳定[19 ] , 有望赋予PVA-CS-6.16-30水凝胶抗溶胀性能. ...
2
... 水凝胶材料含水量高, 生物相容性良好, 且兼具固体的支持性以及液体的传递性优点, 在组织工程和生物医药领域具有广泛的应用前景[1 ~5 ] . 传统水凝胶由于交联方式单一且网络结构不均匀, 机械性能较差. 例如, 壳聚糖(CS)是常用的生物医用材料, 但戊二醛交联的CS水凝胶强度在千帕范围[6 ] . 在CS水凝胶中引入聚丙烯酰胺(PAM)网络可以提高其强度, 但残余AM单体也存在安全隐患[7 ] . 尽管透析可以除去这些物质, 但是大多数水凝胶遇水体积膨胀[8 ] , 不仅会使其强度劣化, 还会损害周围细胞. 因此, 构筑综合性能优异的水凝胶是组织工程领域的难题. ...
... 由于亲水性侧链以及网络通道的存在, 大部分水凝胶遇水膨胀, 极大限制了其实际应用[1 ,8 ,37 ] . 因此, 借鉴文献[11 ]方法评价了其抗溶胀特性. 由图8 (A)可见, 室温下PVA-CS和PVA-CS-6.16-30两种水凝胶在去离子水中浸泡12 h后, 溶胀度分别为67%和0. 同时, PVA-CS水凝胶的直径由10 mm增加至13 mm, 而PVA-CS-6.16-30的直径几乎不变[图8 (B)]. 由图8 (C)和(D)可见, PVA-CS在去离子水中溶胀平衡后其抗拉强度和断裂伸长率分别衰减至0.05 MPa和90%, 与文献报道值接近[33 ] . 而处于溶胀平衡状态的PVA-CS-6.16-30水凝胶的抗拉和抗压强度依然分别高达2.8和7.5 MPa, 远高于常见抗溶胀水凝胶在千帕范围的抗拉强度[10 ,11 ] , 也优于大多数物理交联水凝胶[38 ] . 因为传统水凝胶内部渗透压高于外部水溶液[39 ,40 ] , 而且其多孔结构有利于水分子扩散, 所以遇水后体积显著膨胀. 而PVA-CS-6.16-30水凝胶中的PVA链在形成结晶微区时处于预拉伸状态, 构象熵较低[41 ] , 而非共价键的协同交联作用进一步降低了网络缺陷[16 ] , 因此具有优异的耐溶胀性能. 将1.0 g PVA-CS-6.16-30水凝胶在100 mL去离子水中浸泡2 d后测得水溶液电导率为1.323 μS/cm, 而去离子水的电导率为1.320 μS/cm(表S1, 见本文支持信息). 根据氯化钠浓度与电导率的标准曲线(y =0.6312x +0.01)计算可知, NaCl残余量为0.012 mg/kg, 远低于205(mmol/kg成人体重)的临界安全浓度[17 ] . Yang等[26 ] 制备的PAM/CS水凝胶及Gao等[42 ] 构筑的PVA/NaCl水凝胶(NaCl含量为78.3 g/kg水凝胶)的生物相容性均已得到细胞实验证实. 考虑到CS和PVA的安全性已经得到FDA认证, 且PVA-CS-6.16-30水凝胶中NaCl含量远低于临界安全浓度, 说明该水凝胶具有较好的生物相容性. 进一步评价了PVA-CS-6.16-30水凝胶在生理环境中的耐溶胀性. 将圆柱形水凝胶在37 ℃的PBS(pH=7.4, c =0.01 mol/L)中浸泡7 d后观察其形状并评价机械性能. 由图9 和图10 可见, 浸泡7 d后该水凝胶初始形状保持不变, 且浸泡过程中样品的抗拉和抗压强度几乎与浸泡前相同, 明显优于常见PVA/CS复合水凝胶体系(表S2, 见本文支持信息). ...
1
... 水凝胶的溶胀率由凝胶内外渗透压及高分子链的熵弹性决定, 通过精巧的结构设计可以有效抑制其溶胀程度[9 ~11 ] . Kamata等[10 ] 在四臂聚乙二醇(PEG)水凝胶中引入温度敏感链段, 依靠其在浊点温度以上时的收缩有效抑制了PEG链段的溶胀, 得到了耐溶胀水凝胶. Qin等[11 ] 将多官能团胶束引入聚乙二醇水凝胶网络中增加了交联密度并降低了聚合物链的熵弹性, 所得水凝胶在模拟生理环境中稳定. 但上述耐溶胀水凝胶的抗拉强度在千帕范围内, 而人体软骨可承受兆帕级别的外力而不损坏[12 ~14 ] . 当前, 耐溶胀水凝胶的研究尽管已取得了很大进展, 但复杂的构筑方法、 较高的成本及非生物相容性助剂的使用限制了其实际应用. ...
2
... 水凝胶的溶胀率由凝胶内外渗透压及高分子链的熵弹性决定, 通过精巧的结构设计可以有效抑制其溶胀程度[9 ~11 ] . Kamata等[10 ] 在四臂聚乙二醇(PEG)水凝胶中引入温度敏感链段, 依靠其在浊点温度以上时的收缩有效抑制了PEG链段的溶胀, 得到了耐溶胀水凝胶. Qin等[11 ] 将多官能团胶束引入聚乙二醇水凝胶网络中增加了交联密度并降低了聚合物链的熵弹性, 所得水凝胶在模拟生理环境中稳定. 但上述耐溶胀水凝胶的抗拉强度在千帕范围内, 而人体软骨可承受兆帕级别的外力而不损坏[12 ~14 ] . 当前, 耐溶胀水凝胶的研究尽管已取得了很大进展, 但复杂的构筑方法、 较高的成本及非生物相容性助剂的使用限制了其实际应用. ...
... 由于亲水性侧链以及网络通道的存在, 大部分水凝胶遇水膨胀, 极大限制了其实际应用[1 ,8 ,37 ] . 因此, 借鉴文献[11 ]方法评价了其抗溶胀特性. 由图8 (A)可见, 室温下PVA-CS和PVA-CS-6.16-30两种水凝胶在去离子水中浸泡12 h后, 溶胀度分别为67%和0. 同时, PVA-CS水凝胶的直径由10 mm增加至13 mm, 而PVA-CS-6.16-30的直径几乎不变[图8 (B)]. 由图8 (C)和(D)可见, PVA-CS在去离子水中溶胀平衡后其抗拉强度和断裂伸长率分别衰减至0.05 MPa和90%, 与文献报道值接近[33 ] . 而处于溶胀平衡状态的PVA-CS-6.16-30水凝胶的抗拉和抗压强度依然分别高达2.8和7.5 MPa, 远高于常见抗溶胀水凝胶在千帕范围的抗拉强度[10 ,11 ] , 也优于大多数物理交联水凝胶[38 ] . 因为传统水凝胶内部渗透压高于外部水溶液[39 ,40 ] , 而且其多孔结构有利于水分子扩散, 所以遇水后体积显著膨胀. 而PVA-CS-6.16-30水凝胶中的PVA链在形成结晶微区时处于预拉伸状态, 构象熵较低[41 ] , 而非共价键的协同交联作用进一步降低了网络缺陷[16 ] , 因此具有优异的耐溶胀性能. 将1.0 g PVA-CS-6.16-30水凝胶在100 mL去离子水中浸泡2 d后测得水溶液电导率为1.323 μS/cm, 而去离子水的电导率为1.320 μS/cm(表S1, 见本文支持信息). 根据氯化钠浓度与电导率的标准曲线(y =0.6312x +0.01)计算可知, NaCl残余量为0.012 mg/kg, 远低于205(mmol/kg成人体重)的临界安全浓度[17 ] . Yang等[26 ] 制备的PAM/CS水凝胶及Gao等[42 ] 构筑的PVA/NaCl水凝胶(NaCl含量为78.3 g/kg水凝胶)的生物相容性均已得到细胞实验证实. 考虑到CS和PVA的安全性已经得到FDA认证, 且PVA-CS-6.16-30水凝胶中NaCl含量远低于临界安全浓度, 说明该水凝胶具有较好的生物相容性. 进一步评价了PVA-CS-6.16-30水凝胶在生理环境中的耐溶胀性. 将圆柱形水凝胶在37 ℃的PBS(pH=7.4, c =0.01 mol/L)中浸泡7 d后观察其形状并评价机械性能. 由图9 和图10 可见, 浸泡7 d后该水凝胶初始形状保持不变, 且浸泡过程中样品的抗拉和抗压强度几乎与浸泡前相同, 明显优于常见PVA/CS复合水凝胶体系(表S2, 见本文支持信息). ...
4
... 水凝胶的溶胀率由凝胶内外渗透压及高分子链的熵弹性决定, 通过精巧的结构设计可以有效抑制其溶胀程度[9 ~11 ] . Kamata等[10 ] 在四臂聚乙二醇(PEG)水凝胶中引入温度敏感链段, 依靠其在浊点温度以上时的收缩有效抑制了PEG链段的溶胀, 得到了耐溶胀水凝胶. Qin等[11 ] 将多官能团胶束引入聚乙二醇水凝胶网络中增加了交联密度并降低了聚合物链的熵弹性, 所得水凝胶在模拟生理环境中稳定. 但上述耐溶胀水凝胶的抗拉强度在千帕范围内, 而人体软骨可承受兆帕级别的外力而不损坏[12 ~14 ] . 当前, 耐溶胀水凝胶的研究尽管已取得了很大进展, 但复杂的构筑方法、 较高的成本及非生物相容性助剂的使用限制了其实际应用. ...
... [11 ]将多官能团胶束引入聚乙二醇水凝胶网络中增加了交联密度并降低了聚合物链的熵弹性, 所得水凝胶在模拟生理环境中稳定. 但上述耐溶胀水凝胶的抗拉强度在千帕范围内, 而人体软骨可承受兆帕级别的外力而不损坏[12 ~14 ] . 当前, 耐溶胀水凝胶的研究尽管已取得了很大进展, 但复杂的构筑方法、 较高的成本及非生物相容性助剂的使用限制了其实际应用. ...
... 由于亲水性侧链以及网络通道的存在, 大部分水凝胶遇水膨胀, 极大限制了其实际应用[1 ,8 ,37 ] . 因此, 借鉴文献[11 ]方法评价了其抗溶胀特性. 由图8 (A)可见, 室温下PVA-CS和PVA-CS-6.16-30两种水凝胶在去离子水中浸泡12 h后, 溶胀度分别为67%和0. 同时, PVA-CS水凝胶的直径由10 mm增加至13 mm, 而PVA-CS-6.16-30的直径几乎不变[图8 (B)]. 由图8 (C)和(D)可见, PVA-CS在去离子水中溶胀平衡后其抗拉强度和断裂伸长率分别衰减至0.05 MPa和90%, 与文献报道值接近[33 ] . 而处于溶胀平衡状态的PVA-CS-6.16-30水凝胶的抗拉和抗压强度依然分别高达2.8和7.5 MPa, 远高于常见抗溶胀水凝胶在千帕范围的抗拉强度[10 ,11 ] , 也优于大多数物理交联水凝胶[38 ] . 因为传统水凝胶内部渗透压高于外部水溶液[39 ,40 ] , 而且其多孔结构有利于水分子扩散, 所以遇水后体积显著膨胀. 而PVA-CS-6.16-30水凝胶中的PVA链在形成结晶微区时处于预拉伸状态, 构象熵较低[41 ] , 而非共价键的协同交联作用进一步降低了网络缺陷[16 ] , 因此具有优异的耐溶胀性能. 将1.0 g PVA-CS-6.16-30水凝胶在100 mL去离子水中浸泡2 d后测得水溶液电导率为1.323 μS/cm, 而去离子水的电导率为1.320 μS/cm(表S1, 见本文支持信息). 根据氯化钠浓度与电导率的标准曲线(y =0.6312x +0.01)计算可知, NaCl残余量为0.012 mg/kg, 远低于205(mmol/kg成人体重)的临界安全浓度[17 ] . Yang等[26 ] 制备的PAM/CS水凝胶及Gao等[42 ] 构筑的PVA/NaCl水凝胶(NaCl含量为78.3 g/kg水凝胶)的生物相容性均已得到细胞实验证实. 考虑到CS和PVA的安全性已经得到FDA认证, 且PVA-CS-6.16-30水凝胶中NaCl含量远低于临界安全浓度, 说明该水凝胶具有较好的生物相容性. 进一步评价了PVA-CS-6.16-30水凝胶在生理环境中的耐溶胀性. 将圆柱形水凝胶在37 ℃的PBS(pH=7.4, c =0.01 mol/L)中浸泡7 d后观察其形状并评价机械性能. 由图9 和图10 可见, 浸泡7 d后该水凝胶初始形状保持不变, 且浸泡过程中样品的抗拉和抗压强度几乎与浸泡前相同, 明显优于常见PVA/CS复合水凝胶体系(表S2, 见本文支持信息). ...
... ,11 ], 也优于大多数物理交联水凝胶[38 ] . 因为传统水凝胶内部渗透压高于外部水溶液[39 ,40 ] , 而且其多孔结构有利于水分子扩散, 所以遇水后体积显著膨胀. 而PVA-CS-6.16-30水凝胶中的PVA链在形成结晶微区时处于预拉伸状态, 构象熵较低[41 ] , 而非共价键的协同交联作用进一步降低了网络缺陷[16 ] , 因此具有优异的耐溶胀性能. 将1.0 g PVA-CS-6.16-30水凝胶在100 mL去离子水中浸泡2 d后测得水溶液电导率为1.323 μS/cm, 而去离子水的电导率为1.320 μS/cm(表S1, 见本文支持信息). 根据氯化钠浓度与电导率的标准曲线(y =0.6312x +0.01)计算可知, NaCl残余量为0.012 mg/kg, 远低于205(mmol/kg成人体重)的临界安全浓度[17 ] . Yang等[26 ] 制备的PAM/CS水凝胶及Gao等[42 ] 构筑的PVA/NaCl水凝胶(NaCl含量为78.3 g/kg水凝胶)的生物相容性均已得到细胞实验证实. 考虑到CS和PVA的安全性已经得到FDA认证, 且PVA-CS-6.16-30水凝胶中NaCl含量远低于临界安全浓度, 说明该水凝胶具有较好的生物相容性. 进一步评价了PVA-CS-6.16-30水凝胶在生理环境中的耐溶胀性. 将圆柱形水凝胶在37 ℃的PBS(pH=7.4, c =0.01 mol/L)中浸泡7 d后观察其形状并评价机械性能. 由图9 和图10 可见, 浸泡7 d后该水凝胶初始形状保持不变, 且浸泡过程中样品的抗拉和抗压强度几乎与浸泡前相同, 明显优于常见PVA/CS复合水凝胶体系(表S2, 见本文支持信息). ...
1
... 水凝胶的溶胀率由凝胶内外渗透压及高分子链的熵弹性决定, 通过精巧的结构设计可以有效抑制其溶胀程度[9 ~11 ] . Kamata等[10 ] 在四臂聚乙二醇(PEG)水凝胶中引入温度敏感链段, 依靠其在浊点温度以上时的收缩有效抑制了PEG链段的溶胀, 得到了耐溶胀水凝胶. Qin等[11 ] 将多官能团胶束引入聚乙二醇水凝胶网络中增加了交联密度并降低了聚合物链的熵弹性, 所得水凝胶在模拟生理环境中稳定. 但上述耐溶胀水凝胶的抗拉强度在千帕范围内, 而人体软骨可承受兆帕级别的外力而不损坏[12 ~14 ] . 当前, 耐溶胀水凝胶的研究尽管已取得了很大进展, 但复杂的构筑方法、 较高的成本及非生物相容性助剂的使用限制了其实际应用. ...
1
... 水凝胶的溶胀率由凝胶内外渗透压及高分子链的熵弹性决定, 通过精巧的结构设计可以有效抑制其溶胀程度[9 ~11 ] . Kamata等[10 ] 在四臂聚乙二醇(PEG)水凝胶中引入温度敏感链段, 依靠其在浊点温度以上时的收缩有效抑制了PEG链段的溶胀, 得到了耐溶胀水凝胶. Qin等[11 ] 将多官能团胶束引入聚乙二醇水凝胶网络中增加了交联密度并降低了聚合物链的熵弹性, 所得水凝胶在模拟生理环境中稳定. 但上述耐溶胀水凝胶的抗拉强度在千帕范围内, 而人体软骨可承受兆帕级别的外力而不损坏[12 ~14 ] . 当前, 耐溶胀水凝胶的研究尽管已取得了很大进展, 但复杂的构筑方法、 较高的成本及非生物相容性助剂的使用限制了其实际应用. ...
1
... 本文以商品化聚乙烯醇(PVA)和壳聚糖(CS)为原料构筑了一种强韧、 耐溶胀的复合水凝胶, 并用多种手段揭示了材料微观结构与宏观性能的联系. PVA和CS价格低廉, 安全无毒, PVA和CS混合物的水溶液经过3次冻-融循环(FT)后所得前驱体水凝胶(PVA-CS)保留了原料优异的生物相容性[15 ] ; 将其浸泡在氯化钠水溶液中, 依靠霍夫曼效应[16 ] 诱导亲水CS之间形成链缠结微区, 提高了三维网络的交联密度和机械性能; 将浸泡后的水凝胶进一步在去离子水中透析除去残余氯化钠可以降低高浓度钠盐对细胞的潜在危害[17 ] . 由于PVA结晶微区融化温度在70 ℃附近[18 ] , 而CS链缠结微区在非酸性水溶液中十分稳定 [19 ] , 所得复合水凝胶在模拟生理环境中浸泡7 d后不溶胀, 抗拉和抗压强度分别高达2.8和7.5 MPa, 而且其机械性能可以通过氯化钠浓度与浸泡时间简单调控. 这种方法易于工业化, 有望推动水凝胶在组织工程或生物医疗领域的应用. ...
8
... 本文以商品化聚乙烯醇(PVA)和壳聚糖(CS)为原料构筑了一种强韧、 耐溶胀的复合水凝胶, 并用多种手段揭示了材料微观结构与宏观性能的联系. PVA和CS价格低廉, 安全无毒, PVA和CS混合物的水溶液经过3次冻-融循环(FT)后所得前驱体水凝胶(PVA-CS)保留了原料优异的生物相容性[15 ] ; 将其浸泡在氯化钠水溶液中, 依靠霍夫曼效应[16 ] 诱导亲水CS之间形成链缠结微区, 提高了三维网络的交联密度和机械性能; 将浸泡后的水凝胶进一步在去离子水中透析除去残余氯化钠可以降低高浓度钠盐对细胞的潜在危害[17 ] . 由于PVA结晶微区融化温度在70 ℃附近[18 ] , 而CS链缠结微区在非酸性水溶液中十分稳定 [19 ] , 所得复合水凝胶在模拟生理环境中浸泡7 d后不溶胀, 抗拉和抗压强度分别高达2.8和7.5 MPa, 而且其机械性能可以通过氯化钠浓度与浸泡时间简单调控. 这种方法易于工业化, 有望推动水凝胶在组织工程或生物医疗领域的应用. ...
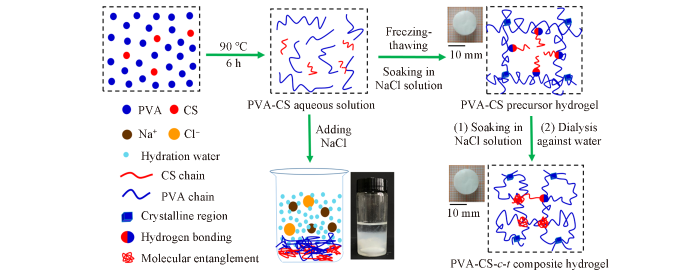
... Scheme 1 示出了复合水凝胶PVA-CS-c -t 的构筑过程. 首先将PVA和CS溶于90 ℃去离子水中(PVA和CS的质量分数分别为10%和0.5%)形成透明溶液, 经过3次冻-融循环得到PVA结晶微区交联的前驱体水凝胶PVA-CS. 将其在特定浓度氯化钠水溶液中浸泡一段时间, 诱导CS链发生亲水-疏水转变形成链缠结微区[16 ] 以提高交联密度. 根据霍夫曼序列可知, 氯化钠中的Cl- 是具有盐析效应的离子[26 ] . 通常, 这类离子与聚合物的水化壳层直接相互作用时会降低水-大分子链的相互作用, 增加聚合物/水界面的界面张力, 降低聚合物在水溶液中的溶解度. 因此, 在PVA与CS混合水溶液中加入NaCl颗粒会诱导大分子聚沉(Scheme 1 中样品瓶所示). 当PVA与CS混合溶液经过冻-融循环形成结晶微区交联的前驱体水凝胶PVA-CS时, 三维网络的存在抑制了宏观相分离的发生. 当浸泡于高浓度NaCl水溶液中时, 由于渗透压和盐析效应, 前驱体水凝胶PVA-CS的直径由14.35 mm降低至13.00 mm, 而厚度由5.50 mm缩小至5.00 mm(图S1, 见本文支持信息), 由此可知浸泡后水凝胶体积降低至初始值的75.6%. 体积收缩促使PVA致密化, 有利于结晶[21 ] , 而CS链在NaCl诱导下会形成疏水链缠结微区[16 ] . 二者的协同作用使水凝胶交联密度和网络均匀性增加, 有利于提高机械性能[27 ] . 在高浓度的盐中浸泡虽然能够提高水凝胶的机械性能, 但会打破生命体常规渗透压并造成组织损伤[17 ] . 因此, 最后采用透析方法除去残余NaCl, 得到目标水凝胶PVA-CS-c -t . 如氯化钠浓度为6.16 mol/L, 浸泡时间为30 min时所得复合水凝胶记为PVA-CS-6.16-30. ...
... [16 ]. 二者的协同作用使水凝胶交联密度和网络均匀性增加, 有利于提高机械性能[27 ] . 在高浓度的盐中浸泡虽然能够提高水凝胶的机械性能, 但会打破生命体常规渗透压并造成组织损伤[17 ] . 因此, 最后采用透析方法除去残余NaCl, 得到目标水凝胶PVA-CS-c -t . 如氯化钠浓度为6.16 mol/L, 浸泡时间为30 min时所得复合水凝胶记为PVA-CS-6.16-30. ...
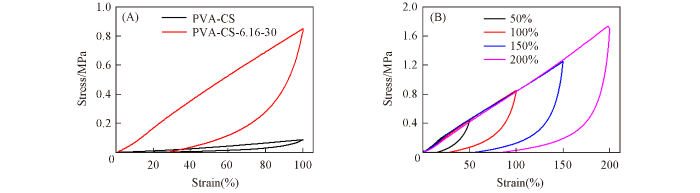
... CS的溶解性与溶液pH值及离子强度有关[16 ] . 例如, Yang等[26 ] 将PAM/CS水凝胶在柠檬酸钠水溶液中浸泡后, 其抗拉强度由0.15 MPa提高到了5.6 MPa. 由于NaCl也是一种具有霍夫曼效应的盐[30 ] , 而PVA/CS复合水凝胶机械性能欠佳[6 ] , 因此采用NaCl水溶液浸泡的方法来提高水凝胶的机械性能. 图S2(见本文支持信息)表明, 当PVA与CS的质量比为100∶5时, 前驱体水凝胶的机械性能最佳. 其 抗拉强度、 断裂伸长率、 拉伸模量、 韧性和抗压强度分别为0.22 MPa, 152%, 0.027 MPa, 0.13 MJ/m3 [图2 (A)]和1.5 MPa[图2 (B)]. 而复合水凝胶PVA-CS-6.16-30的抗拉强度、 断裂伸长率、 拉伸模量、 韧性和抗压强度显著提高至2.9 MPa, 229%, 1.13 MPa, 3.3 MJ/m3 [图2 (A)]和7.6 MPa[图2 (B)]. 此外, 该复合水凝胶还具有优异的抗疲劳特性, 连续压缩10次后其抗压强度依然为初始值的85%[图2 (C)]. 低于100%的可能原因是氢键、 结晶微区及链缠结等交联点的可逆断裂与重组具有依时性[31 ] . 同时, 复合水凝胶PVA-CS-6.16-30还具有良好的抗蠕变性能, 相同作用力下其形变仅为0.42%, 而PVA-CS的形变为0.74%[图2 (D)插图]. 此外, 复合水凝胶PVA-CS-6.16-30的柔量为3.1×10‒5 Pa‒1 , 仅为PVA-CS的10%[图2 (D)], 说明该复合水凝胶具有良好的抗蠕变性能[32 ] . 上述实验证明在NaCl水溶液中浸泡后前驱体水凝胶PVA-CS的机械性能得到了极大的提升. ...
... 结合DSC、 XRD、 SEM及流变分析揭示了水凝胶的微观结构. 首先, 利用DSC[6 ] 测试了PVA-CS和PVA-CS-6.16-30水凝胶中自由水与结合水的含量[图4 (A)]. PVA-CS在1.5 ℃处出现了自由水的吸热峰[6 ] , 其熔融焓为209.4 J/g, 由式(2) 可计算出自由水质量分数为62.8%, 由总含水量(89.1%)减去自由水含量可知结合水含量为26.3%. 而PVA-CS-6.16-30中自由水的熔融焓降低至175.4 J/g, 由式(2) 可知自由水含量为52.6%. 由总含水量(81.9%)减去自由水含量可知结合水含量为 29.3%. 通常自由水含量降低, 水凝胶内摩擦阻力增加[35 ] . 采用XRD分析了原料PVA与CS的结晶度(图S4, 见本文支持信息). 可见, 原料CS没有明显衍射峰, 说明CS粉末中不存在晶体结构[16 ] ; 而PVA粉末在2θ 值为19.6°处出现了较强的特征衍射峰, 对应PVA的(101)晶面[21 ] . 由2θ 值为18°~21°之间的积分面积(1284.9)除以衍射曲线下方总面积(8988.3), 利用式(3) 可计算出PVA粉末的结晶度等于14.3%. 进一步利用XRD分析了后处理对水凝胶中PVA结晶度的影响. 由图4 (B)可见, 两种水凝胶在2θ 值为 18°~21°之间均出现了PVA的(101)晶面的特征衍射峰[21 ] , 利用式(3) 可计算出PVA结晶度. 结果表明, 后处理使PVA结晶度由14.8%增加至17.2%[21 ] . 这是因为NaCl浸泡过程中水凝胶体积收缩, PVA排列更紧密, 有利于结晶[21 ] . 通常, 自由含水率下降, 结晶度增加, 材料机械性能会提高[18 ] . ...
... 综合上述实验提出如下增强机理: PVA链在冻-融循环中形成的结晶微区构成了水凝胶的初级交联点. 由于冻-融循环时结晶微区无序形成和生长, 且不具备高效的能量耗散机制[36 ] , 所以单网络PVA水凝胶的抗拉强度仅为0.15 MPa. 而借鉴双网络设计理念[7 ] 在PVA水溶液中加入少量CS(5%), 可将前驱体水凝胶PVA-CS的抗拉强度增加至0.22 MPa(图S2, 见本文支持信息). 由于PVA与CS之间的氢键较强, 有利于CS分子链均匀分布在黏性PVA三维网络中. 当在高浓度NaCl水溶液中浸泡时, 由于渗透压作用, 水凝胶体积收缩, 使PVA结晶度由14.8%增加至17.2%, 同时含水率由89.1%降低至81.9%. 尤为重要的是, Cl- 的霍夫曼效应降低了PVA和CS与水分子之间的相互作用, 增加了聚合物/水界面的界面张力[30 ] , 导致大分子链水溶性降低, 从而沉淀在样品瓶底部(Scheme 1 ). 水凝胶三维网络的受限空间抑制了宏观相分离的发生 [30 ] , 因此CS链在凝胶网络内形成链缠结疏水微区[16 ] . 由于CS链缠结微区在非酸性水溶液中十分稳定[19 ] , 将盐水替换为去离子水并搅拌后CS溶液依然浑浊(图S5, 见本文支持信息). 因此, 用去离子水透析2 d除去残余NaCl时大部分CS链依然以链缠结微区形式充当交联点[16 ] , 而PVA的水合作用使水凝胶体积增加至透析前的1.24倍(图S6, 见本文支持信息). 上述作用增加了水凝胶交联密度, 并有效减少了端链、 无效交联点及封闭的链段等网络缺陷. 与PVA-CS水凝胶相比, PVA-CS-6.16-30水凝胶的交联密度由7.69×10-4 mol/cm3 增加至9.97×10-4 mol/cm3 , 网孔尺寸由 6.11 nm降低至5.21 nm, 凝胶分数由58.6%增加至86.8%, 网络均匀性和致密性提高. 此外, 自由水含量由62.8%降低至52.6%, 水凝胶内摩擦力和黏弹性增加. 而氢键和疏水微区等非共价键在外力下的可逆断裂与重组耗散了大量能量, 使PVA-CS-6.16-30水凝胶的抗拉强度显著增加至2.9 MPa. 由于PVA结晶微区融化温度在70 ℃附近[18 ] , 而CS链缠结微区在非酸性水溶液中十分稳定[19 ] , 有望赋予PVA-CS-6.16-30水凝胶抗溶胀性能. ...
... [16 ], 而PVA的水合作用使水凝胶体积增加至透析前的1.24倍(图S6, 见本文支持信息). 上述作用增加了水凝胶交联密度, 并有效减少了端链、 无效交联点及封闭的链段等网络缺陷. 与PVA-CS水凝胶相比, PVA-CS-6.16-30水凝胶的交联密度由7.69×10-4 mol/cm3 增加至9.97×10-4 mol/cm3 , 网孔尺寸由 6.11 nm降低至5.21 nm, 凝胶分数由58.6%增加至86.8%, 网络均匀性和致密性提高. 此外, 自由水含量由62.8%降低至52.6%, 水凝胶内摩擦力和黏弹性增加. 而氢键和疏水微区等非共价键在外力下的可逆断裂与重组耗散了大量能量, 使PVA-CS-6.16-30水凝胶的抗拉强度显著增加至2.9 MPa. 由于PVA结晶微区融化温度在70 ℃附近[18 ] , 而CS链缠结微区在非酸性水溶液中十分稳定[19 ] , 有望赋予PVA-CS-6.16-30水凝胶抗溶胀性能. ...
... 由于亲水性侧链以及网络通道的存在, 大部分水凝胶遇水膨胀, 极大限制了其实际应用[1 ,8 ,37 ] . 因此, 借鉴文献[11 ]方法评价了其抗溶胀特性. 由图8 (A)可见, 室温下PVA-CS和PVA-CS-6.16-30两种水凝胶在去离子水中浸泡12 h后, 溶胀度分别为67%和0. 同时, PVA-CS水凝胶的直径由10 mm增加至13 mm, 而PVA-CS-6.16-30的直径几乎不变[图8 (B)]. 由图8 (C)和(D)可见, PVA-CS在去离子水中溶胀平衡后其抗拉强度和断裂伸长率分别衰减至0.05 MPa和90%, 与文献报道值接近[33 ] . 而处于溶胀平衡状态的PVA-CS-6.16-30水凝胶的抗拉和抗压强度依然分别高达2.8和7.5 MPa, 远高于常见抗溶胀水凝胶在千帕范围的抗拉强度[10 ,11 ] , 也优于大多数物理交联水凝胶[38 ] . 因为传统水凝胶内部渗透压高于外部水溶液[39 ,40 ] , 而且其多孔结构有利于水分子扩散, 所以遇水后体积显著膨胀. 而PVA-CS-6.16-30水凝胶中的PVA链在形成结晶微区时处于预拉伸状态, 构象熵较低[41 ] , 而非共价键的协同交联作用进一步降低了网络缺陷[16 ] , 因此具有优异的耐溶胀性能. 将1.0 g PVA-CS-6.16-30水凝胶在100 mL去离子水中浸泡2 d后测得水溶液电导率为1.323 μS/cm, 而去离子水的电导率为1.320 μS/cm(表S1, 见本文支持信息). 根据氯化钠浓度与电导率的标准曲线(y =0.6312x +0.01)计算可知, NaCl残余量为0.012 mg/kg, 远低于205(mmol/kg成人体重)的临界安全浓度[17 ] . Yang等[26 ] 制备的PAM/CS水凝胶及Gao等[42 ] 构筑的PVA/NaCl水凝胶(NaCl含量为78.3 g/kg水凝胶)的生物相容性均已得到细胞实验证实. 考虑到CS和PVA的安全性已经得到FDA认证, 且PVA-CS-6.16-30水凝胶中NaCl含量远低于临界安全浓度, 说明该水凝胶具有较好的生物相容性. 进一步评价了PVA-CS-6.16-30水凝胶在生理环境中的耐溶胀性. 将圆柱形水凝胶在37 ℃的PBS(pH=7.4, c =0.01 mol/L)中浸泡7 d后观察其形状并评价机械性能. 由图9 和图10 可见, 浸泡7 d后该水凝胶初始形状保持不变, 且浸泡过程中样品的抗拉和抗压强度几乎与浸泡前相同, 明显优于常见PVA/CS复合水凝胶体系(表S2, 见本文支持信息). ...
3
... 本文以商品化聚乙烯醇(PVA)和壳聚糖(CS)为原料构筑了一种强韧、 耐溶胀的复合水凝胶, 并用多种手段揭示了材料微观结构与宏观性能的联系. PVA和CS价格低廉, 安全无毒, PVA和CS混合物的水溶液经过3次冻-融循环(FT)后所得前驱体水凝胶(PVA-CS)保留了原料优异的生物相容性[15 ] ; 将其浸泡在氯化钠水溶液中, 依靠霍夫曼效应[16 ] 诱导亲水CS之间形成链缠结微区, 提高了三维网络的交联密度和机械性能; 将浸泡后的水凝胶进一步在去离子水中透析除去残余氯化钠可以降低高浓度钠盐对细胞的潜在危害[17 ] . 由于PVA结晶微区融化温度在70 ℃附近[18 ] , 而CS链缠结微区在非酸性水溶液中十分稳定 [19 ] , 所得复合水凝胶在模拟生理环境中浸泡7 d后不溶胀, 抗拉和抗压强度分别高达2.8和7.5 MPa, 而且其机械性能可以通过氯化钠浓度与浸泡时间简单调控. 这种方法易于工业化, 有望推动水凝胶在组织工程或生物医疗领域的应用. ...
... Scheme 1 示出了复合水凝胶PVA-CS-c -t 的构筑过程. 首先将PVA和CS溶于90 ℃去离子水中(PVA和CS的质量分数分别为10%和0.5%)形成透明溶液, 经过3次冻-融循环得到PVA结晶微区交联的前驱体水凝胶PVA-CS. 将其在特定浓度氯化钠水溶液中浸泡一段时间, 诱导CS链发生亲水-疏水转变形成链缠结微区[16 ] 以提高交联密度. 根据霍夫曼序列可知, 氯化钠中的Cl- 是具有盐析效应的离子[26 ] . 通常, 这类离子与聚合物的水化壳层直接相互作用时会降低水-大分子链的相互作用, 增加聚合物/水界面的界面张力, 降低聚合物在水溶液中的溶解度. 因此, 在PVA与CS混合水溶液中加入NaCl颗粒会诱导大分子聚沉(Scheme 1 中样品瓶所示). 当PVA与CS混合溶液经过冻-融循环形成结晶微区交联的前驱体水凝胶PVA-CS时, 三维网络的存在抑制了宏观相分离的发生. 当浸泡于高浓度NaCl水溶液中时, 由于渗透压和盐析效应, 前驱体水凝胶PVA-CS的直径由14.35 mm降低至13.00 mm, 而厚度由5.50 mm缩小至5.00 mm(图S1, 见本文支持信息), 由此可知浸泡后水凝胶体积降低至初始值的75.6%. 体积收缩促使PVA致密化, 有利于结晶[21 ] , 而CS链在NaCl诱导下会形成疏水链缠结微区[16 ] . 二者的协同作用使水凝胶交联密度和网络均匀性增加, 有利于提高机械性能[27 ] . 在高浓度的盐中浸泡虽然能够提高水凝胶的机械性能, 但会打破生命体常规渗透压并造成组织损伤[17 ] . 因此, 最后采用透析方法除去残余NaCl, 得到目标水凝胶PVA-CS-c -t . 如氯化钠浓度为6.16 mol/L, 浸泡时间为30 min时所得复合水凝胶记为PVA-CS-6.16-30. ...
... 由于亲水性侧链以及网络通道的存在, 大部分水凝胶遇水膨胀, 极大限制了其实际应用[1 ,8 ,37 ] . 因此, 借鉴文献[11 ]方法评价了其抗溶胀特性. 由图8 (A)可见, 室温下PVA-CS和PVA-CS-6.16-30两种水凝胶在去离子水中浸泡12 h后, 溶胀度分别为67%和0. 同时, PVA-CS水凝胶的直径由10 mm增加至13 mm, 而PVA-CS-6.16-30的直径几乎不变[图8 (B)]. 由图8 (C)和(D)可见, PVA-CS在去离子水中溶胀平衡后其抗拉强度和断裂伸长率分别衰减至0.05 MPa和90%, 与文献报道值接近[33 ] . 而处于溶胀平衡状态的PVA-CS-6.16-30水凝胶的抗拉和抗压强度依然分别高达2.8和7.5 MPa, 远高于常见抗溶胀水凝胶在千帕范围的抗拉强度[10 ,11 ] , 也优于大多数物理交联水凝胶[38 ] . 因为传统水凝胶内部渗透压高于外部水溶液[39 ,40 ] , 而且其多孔结构有利于水分子扩散, 所以遇水后体积显著膨胀. 而PVA-CS-6.16-30水凝胶中的PVA链在形成结晶微区时处于预拉伸状态, 构象熵较低[41 ] , 而非共价键的协同交联作用进一步降低了网络缺陷[16 ] , 因此具有优异的耐溶胀性能. 将1.0 g PVA-CS-6.16-30水凝胶在100 mL去离子水中浸泡2 d后测得水溶液电导率为1.323 μS/cm, 而去离子水的电导率为1.320 μS/cm(表S1, 见本文支持信息). 根据氯化钠浓度与电导率的标准曲线(y =0.6312x +0.01)计算可知, NaCl残余量为0.012 mg/kg, 远低于205(mmol/kg成人体重)的临界安全浓度[17 ] . Yang等[26 ] 制备的PAM/CS水凝胶及Gao等[42 ] 构筑的PVA/NaCl水凝胶(NaCl含量为78.3 g/kg水凝胶)的生物相容性均已得到细胞实验证实. 考虑到CS和PVA的安全性已经得到FDA认证, 且PVA-CS-6.16-30水凝胶中NaCl含量远低于临界安全浓度, 说明该水凝胶具有较好的生物相容性. 进一步评价了PVA-CS-6.16-30水凝胶在生理环境中的耐溶胀性. 将圆柱形水凝胶在37 ℃的PBS(pH=7.4, c =0.01 mol/L)中浸泡7 d后观察其形状并评价机械性能. 由图9 和图10 可见, 浸泡7 d后该水凝胶初始形状保持不变, 且浸泡过程中样品的抗拉和抗压强度几乎与浸泡前相同, 明显优于常见PVA/CS复合水凝胶体系(表S2, 见本文支持信息). ...
3
... 本文以商品化聚乙烯醇(PVA)和壳聚糖(CS)为原料构筑了一种强韧、 耐溶胀的复合水凝胶, 并用多种手段揭示了材料微观结构与宏观性能的联系. PVA和CS价格低廉, 安全无毒, PVA和CS混合物的水溶液经过3次冻-融循环(FT)后所得前驱体水凝胶(PVA-CS)保留了原料优异的生物相容性[15 ] ; 将其浸泡在氯化钠水溶液中, 依靠霍夫曼效应[16 ] 诱导亲水CS之间形成链缠结微区, 提高了三维网络的交联密度和机械性能; 将浸泡后的水凝胶进一步在去离子水中透析除去残余氯化钠可以降低高浓度钠盐对细胞的潜在危害[17 ] . 由于PVA结晶微区融化温度在70 ℃附近[18 ] , 而CS链缠结微区在非酸性水溶液中十分稳定 [19 ] , 所得复合水凝胶在模拟生理环境中浸泡7 d后不溶胀, 抗拉和抗压强度分别高达2.8和7.5 MPa, 而且其机械性能可以通过氯化钠浓度与浸泡时间简单调控. 这种方法易于工业化, 有望推动水凝胶在组织工程或生物医疗领域的应用. ...
... 结合DSC、 XRD、 SEM及流变分析揭示了水凝胶的微观结构. 首先, 利用DSC[6 ] 测试了PVA-CS和PVA-CS-6.16-30水凝胶中自由水与结合水的含量[图4 (A)]. PVA-CS在1.5 ℃处出现了自由水的吸热峰[6 ] , 其熔融焓为209.4 J/g, 由式(2) 可计算出自由水质量分数为62.8%, 由总含水量(89.1%)减去自由水含量可知结合水含量为26.3%. 而PVA-CS-6.16-30中自由水的熔融焓降低至175.4 J/g, 由式(2) 可知自由水含量为52.6%. 由总含水量(81.9%)减去自由水含量可知结合水含量为 29.3%. 通常自由水含量降低, 水凝胶内摩擦阻力增加[35 ] . 采用XRD分析了原料PVA与CS的结晶度(图S4, 见本文支持信息). 可见, 原料CS没有明显衍射峰, 说明CS粉末中不存在晶体结构[16 ] ; 而PVA粉末在2θ 值为19.6°处出现了较强的特征衍射峰, 对应PVA的(101)晶面[21 ] . 由2θ 值为18°~21°之间的积分面积(1284.9)除以衍射曲线下方总面积(8988.3), 利用式(3) 可计算出PVA粉末的结晶度等于14.3%. 进一步利用XRD分析了后处理对水凝胶中PVA结晶度的影响. 由图4 (B)可见, 两种水凝胶在2θ 值为 18°~21°之间均出现了PVA的(101)晶面的特征衍射峰[21 ] , 利用式(3) 可计算出PVA结晶度. 结果表明, 后处理使PVA结晶度由14.8%增加至17.2%[21 ] . 这是因为NaCl浸泡过程中水凝胶体积收缩, PVA排列更紧密, 有利于结晶[21 ] . 通常, 自由含水率下降, 结晶度增加, 材料机械性能会提高[18 ] . ...
... 综合上述实验提出如下增强机理: PVA链在冻-融循环中形成的结晶微区构成了水凝胶的初级交联点. 由于冻-融循环时结晶微区无序形成和生长, 且不具备高效的能量耗散机制[36 ] , 所以单网络PVA水凝胶的抗拉强度仅为0.15 MPa. 而借鉴双网络设计理念[7 ] 在PVA水溶液中加入少量CS(5%), 可将前驱体水凝胶PVA-CS的抗拉强度增加至0.22 MPa(图S2, 见本文支持信息). 由于PVA与CS之间的氢键较强, 有利于CS分子链均匀分布在黏性PVA三维网络中. 当在高浓度NaCl水溶液中浸泡时, 由于渗透压作用, 水凝胶体积收缩, 使PVA结晶度由14.8%增加至17.2%, 同时含水率由89.1%降低至81.9%. 尤为重要的是, Cl- 的霍夫曼效应降低了PVA和CS与水分子之间的相互作用, 增加了聚合物/水界面的界面张力[30 ] , 导致大分子链水溶性降低, 从而沉淀在样品瓶底部(Scheme 1 ). 水凝胶三维网络的受限空间抑制了宏观相分离的发生 [30 ] , 因此CS链在凝胶网络内形成链缠结疏水微区[16 ] . 由于CS链缠结微区在非酸性水溶液中十分稳定[19 ] , 将盐水替换为去离子水并搅拌后CS溶液依然浑浊(图S5, 见本文支持信息). 因此, 用去离子水透析2 d除去残余NaCl时大部分CS链依然以链缠结微区形式充当交联点[16 ] , 而PVA的水合作用使水凝胶体积增加至透析前的1.24倍(图S6, 见本文支持信息). 上述作用增加了水凝胶交联密度, 并有效减少了端链、 无效交联点及封闭的链段等网络缺陷. 与PVA-CS水凝胶相比, PVA-CS-6.16-30水凝胶的交联密度由7.69×10-4 mol/cm3 增加至9.97×10-4 mol/cm3 , 网孔尺寸由 6.11 nm降低至5.21 nm, 凝胶分数由58.6%增加至86.8%, 网络均匀性和致密性提高. 此外, 自由水含量由62.8%降低至52.6%, 水凝胶内摩擦力和黏弹性增加. 而氢键和疏水微区等非共价键在外力下的可逆断裂与重组耗散了大量能量, 使PVA-CS-6.16-30水凝胶的抗拉强度显著增加至2.9 MPa. 由于PVA结晶微区融化温度在70 ℃附近[18 ] , 而CS链缠结微区在非酸性水溶液中十分稳定[19 ] , 有望赋予PVA-CS-6.16-30水凝胶抗溶胀性能. ...
3
... 本文以商品化聚乙烯醇(PVA)和壳聚糖(CS)为原料构筑了一种强韧、 耐溶胀的复合水凝胶, 并用多种手段揭示了材料微观结构与宏观性能的联系. PVA和CS价格低廉, 安全无毒, PVA和CS混合物的水溶液经过3次冻-融循环(FT)后所得前驱体水凝胶(PVA-CS)保留了原料优异的生物相容性[15 ] ; 将其浸泡在氯化钠水溶液中, 依靠霍夫曼效应[16 ] 诱导亲水CS之间形成链缠结微区, 提高了三维网络的交联密度和机械性能; 将浸泡后的水凝胶进一步在去离子水中透析除去残余氯化钠可以降低高浓度钠盐对细胞的潜在危害[17 ] . 由于PVA结晶微区融化温度在70 ℃附近[18 ] , 而CS链缠结微区在非酸性水溶液中十分稳定 [19 ] , 所得复合水凝胶在模拟生理环境中浸泡7 d后不溶胀, 抗拉和抗压强度分别高达2.8和7.5 MPa, 而且其机械性能可以通过氯化钠浓度与浸泡时间简单调控. 这种方法易于工业化, 有望推动水凝胶在组织工程或生物医疗领域的应用. ...
... 综合上述实验提出如下增强机理: PVA链在冻-融循环中形成的结晶微区构成了水凝胶的初级交联点. 由于冻-融循环时结晶微区无序形成和生长, 且不具备高效的能量耗散机制[36 ] , 所以单网络PVA水凝胶的抗拉强度仅为0.15 MPa. 而借鉴双网络设计理念[7 ] 在PVA水溶液中加入少量CS(5%), 可将前驱体水凝胶PVA-CS的抗拉强度增加至0.22 MPa(图S2, 见本文支持信息). 由于PVA与CS之间的氢键较强, 有利于CS分子链均匀分布在黏性PVA三维网络中. 当在高浓度NaCl水溶液中浸泡时, 由于渗透压作用, 水凝胶体积收缩, 使PVA结晶度由14.8%增加至17.2%, 同时含水率由89.1%降低至81.9%. 尤为重要的是, Cl- 的霍夫曼效应降低了PVA和CS与水分子之间的相互作用, 增加了聚合物/水界面的界面张力[30 ] , 导致大分子链水溶性降低, 从而沉淀在样品瓶底部(Scheme 1 ). 水凝胶三维网络的受限空间抑制了宏观相分离的发生 [30 ] , 因此CS链在凝胶网络内形成链缠结疏水微区[16 ] . 由于CS链缠结微区在非酸性水溶液中十分稳定[19 ] , 将盐水替换为去离子水并搅拌后CS溶液依然浑浊(图S5, 见本文支持信息). 因此, 用去离子水透析2 d除去残余NaCl时大部分CS链依然以链缠结微区形式充当交联点[16 ] , 而PVA的水合作用使水凝胶体积增加至透析前的1.24倍(图S6, 见本文支持信息). 上述作用增加了水凝胶交联密度, 并有效减少了端链、 无效交联点及封闭的链段等网络缺陷. 与PVA-CS水凝胶相比, PVA-CS-6.16-30水凝胶的交联密度由7.69×10-4 mol/cm3 增加至9.97×10-4 mol/cm3 , 网孔尺寸由 6.11 nm降低至5.21 nm, 凝胶分数由58.6%增加至86.8%, 网络均匀性和致密性提高. 此外, 自由水含量由62.8%降低至52.6%, 水凝胶内摩擦力和黏弹性增加. 而氢键和疏水微区等非共价键在外力下的可逆断裂与重组耗散了大量能量, 使PVA-CS-6.16-30水凝胶的抗拉强度显著增加至2.9 MPa. 由于PVA结晶微区融化温度在70 ℃附近[18 ] , 而CS链缠结微区在非酸性水溶液中十分稳定[19 ] , 有望赋予PVA-CS-6.16-30水凝胶抗溶胀性能. ...
... [19 ], 有望赋予PVA-CS-6.16-30水凝胶抗溶胀性能. ...
3
... 德国ZEISS公司EVO18型扫描电子显微镜(SEM), 水凝胶用液氮淬断后冻干脱水, 测试前表面喷金; 美国Thermo公司Nicolet Avatar 380型傅里叶变换红外光谱仪(FTIR), KBr压片法, 扫描范围为500~4000 cm‒1 ; 美国Anton Paar公司MCR302型动态流变仪, 平行板, 直径50 mm, 板间距为1 mm, 扫描区间0.01~100 rad/s[20 ] ; 日本Rigaku公司SmartLab型X射线衍射仪(XRD), Cu Kα 辐射源, 管电压30 kV, 管电流30 mA, 扫描速率5°/min, 扫描范围为5°~80°(2θ ); 美国TA仪器公司Q20型差示扫描量热仪(DSC), 氮气氛围, 升温速率1 ℃/ min, 测试温度为‒40 ~ 40 ℃; 东莞市力显仪器科技有限公司电子拉力机, 测试温度为25 ℃. ...
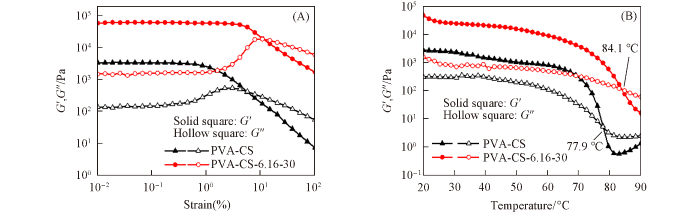
... 采用流变仪研究了两种水凝胶的储能模量(G ′)和损耗模量(G ″)与频率及温度的关系. 由图7 可见, 两种水凝胶的G ′均大于G ″, 说明其为凝胶结构[20 ] . 由图7 (B)可知, PVA-CS水凝胶的凝胶-溶液相转变温度为77.9 ℃, 而PVA-CS-6.16-30水凝胶的相转变温度增加至84.1 ℃. 这可能是霍夫曼效应增强了聚合物分子链之间的氢键作用力所致[20 ] , 与FTIR分析结论一致. ...
... [20 ], 与FTIR分析结论一致. ...
7
... 水凝胶的结晶度(χ c )根据下式计算[21 ] : ...
... Scheme 1 示出了复合水凝胶PVA-CS-c -t 的构筑过程. 首先将PVA和CS溶于90 ℃去离子水中(PVA和CS的质量分数分别为10%和0.5%)形成透明溶液, 经过3次冻-融循环得到PVA结晶微区交联的前驱体水凝胶PVA-CS. 将其在特定浓度氯化钠水溶液中浸泡一段时间, 诱导CS链发生亲水-疏水转变形成链缠结微区[16 ] 以提高交联密度. 根据霍夫曼序列可知, 氯化钠中的Cl- 是具有盐析效应的离子[26 ] . 通常, 这类离子与聚合物的水化壳层直接相互作用时会降低水-大分子链的相互作用, 增加聚合物/水界面的界面张力, 降低聚合物在水溶液中的溶解度. 因此, 在PVA与CS混合水溶液中加入NaCl颗粒会诱导大分子聚沉(Scheme 1 中样品瓶所示). 当PVA与CS混合溶液经过冻-融循环形成结晶微区交联的前驱体水凝胶PVA-CS时, 三维网络的存在抑制了宏观相分离的发生. 当浸泡于高浓度NaCl水溶液中时, 由于渗透压和盐析效应, 前驱体水凝胶PVA-CS的直径由14.35 mm降低至13.00 mm, 而厚度由5.50 mm缩小至5.00 mm(图S1, 见本文支持信息), 由此可知浸泡后水凝胶体积降低至初始值的75.6%. 体积收缩促使PVA致密化, 有利于结晶[21 ] , 而CS链在NaCl诱导下会形成疏水链缠结微区[16 ] . 二者的协同作用使水凝胶交联密度和网络均匀性增加, 有利于提高机械性能[27 ] . 在高浓度的盐中浸泡虽然能够提高水凝胶的机械性能, 但会打破生命体常规渗透压并造成组织损伤[17 ] . 因此, 最后采用透析方法除去残余NaCl, 得到目标水凝胶PVA-CS-c -t . 如氯化钠浓度为6.16 mol/L, 浸泡时间为30 min时所得复合水凝胶记为PVA-CS-6.16-30. ...
... 水凝胶的机械性能与含水率、 微观结构以及交联特点有关[30 ,33 ,34 ] . 由称重法利用式(1) 可知PVA-CS和PVA-CS-6.16-30的含水率分别为89.1%和81.9%. 通常, 含水率下降, 水凝胶机械性能提升. 为阐明PVA-CS-6.16-30的增强机理, 将17.24 g PVA和0.86 g CS溶于81.9 g去离子水中, 并经过3次冻-融循环制备了参比水凝胶, 其组成及含量与复合水凝胶PVA-CS-6.16-30一致. 拉力机测试结果表明其抗拉强度和抗压强度仅为0.54 MPa和1.6 MPa(图S3, 见本文支持信息). 尽管两种水凝胶中PVA, CS及水含量完全相同, 但PVA-CS-6.16-30抗拉强度和抗压强度是参比水凝胶的5.4和4.8倍, 说明含水率下降不是PVA-CS-6.16-30机械性能提升的主要原因. 这是因为, 水凝胶的机械性能不仅取决于聚合物组成和质量分数, 还与结晶微区和相分离程度等微观结构以及交联特点有关[21 ,34 ] . ...
... 结合DSC、 XRD、 SEM及流变分析揭示了水凝胶的微观结构. 首先, 利用DSC[6 ] 测试了PVA-CS和PVA-CS-6.16-30水凝胶中自由水与结合水的含量[图4 (A)]. PVA-CS在1.5 ℃处出现了自由水的吸热峰[6 ] , 其熔融焓为209.4 J/g, 由式(2) 可计算出自由水质量分数为62.8%, 由总含水量(89.1%)减去自由水含量可知结合水含量为26.3%. 而PVA-CS-6.16-30中自由水的熔融焓降低至175.4 J/g, 由式(2) 可知自由水含量为52.6%. 由总含水量(81.9%)减去自由水含量可知结合水含量为 29.3%. 通常自由水含量降低, 水凝胶内摩擦阻力增加[35 ] . 采用XRD分析了原料PVA与CS的结晶度(图S4, 见本文支持信息). 可见, 原料CS没有明显衍射峰, 说明CS粉末中不存在晶体结构[16 ] ; 而PVA粉末在2θ 值为19.6°处出现了较强的特征衍射峰, 对应PVA的(101)晶面[21 ] . 由2θ 值为18°~21°之间的积分面积(1284.9)除以衍射曲线下方总面积(8988.3), 利用式(3) 可计算出PVA粉末的结晶度等于14.3%. 进一步利用XRD分析了后处理对水凝胶中PVA结晶度的影响. 由图4 (B)可见, 两种水凝胶在2θ 值为 18°~21°之间均出现了PVA的(101)晶面的特征衍射峰[21 ] , 利用式(3) 可计算出PVA结晶度. 结果表明, 后处理使PVA结晶度由14.8%增加至17.2%[21 ] . 这是因为NaCl浸泡过程中水凝胶体积收缩, PVA排列更紧密, 有利于结晶[21 ] . 通常, 自由含水率下降, 结晶度增加, 材料机械性能会提高[18 ] . ...
... [21 ], 利用式(3) 可计算出PVA结晶度. 结果表明, 后处理使PVA结晶度由14.8%增加至17.2%[21 ] . 这是因为NaCl浸泡过程中水凝胶体积收缩, PVA排列更紧密, 有利于结晶[21 ] . 通常, 自由含水率下降, 结晶度增加, 材料机械性能会提高[18 ] . ...
... [21 ]. 这是因为NaCl浸泡过程中水凝胶体积收缩, PVA排列更紧密, 有利于结晶[21 ] . 通常, 自由含水率下降, 结晶度增加, 材料机械性能会提高[18 ] . ...
... [21 ]. 通常, 自由含水率下降, 结晶度增加, 材料机械性能会提高[18 ] . ...
1
... 采用称重法计算水凝胶的溶胀度(SR, %). 将质量为 m d (g)的水凝胶分别浸泡在25 ℃的去离子水及37 ℃的磷酸盐缓冲溶液里(PBS, pH=7.4, c =0.01 mol/L)中, 间隔一定时间(t =1, 3, 5, 7 d)取出称重, 记为mt , 利用下式计算溶胀度(SR)[22 ] : ...
1
... 采用质量法, 根据下式计算水凝胶的凝胶分数(F g , %)[23 ] : ...
1
... 采用电子拉力机于室温下测试水凝胶的机械性能, 水凝胶样品宽度为10 mm, 厚度1.5 mm. 将样品以100 mm/min的速度匀速拉断, 测出应力-应变曲线. 其中, 应力(σ , MPa)、 应变(ε , %)、 杨氏模量(E , MPa)和韧性(T , MJ/m3 )分别指断裂压强、 断裂伸长率、 σ⁃ε 曲线弹性区斜率及σ -ε曲线积分面积, 根据滞后实验计算耗散能[24 ] . 借鉴橡胶弹性理论, 利用公式(7 )~(10 )计算水凝胶的交联点之间的相对分子质量(M ¯ c )、 交联密度(ρ c , mol/cm3 )、 网孔尺寸(ξ , nm)及有效交联密度(v exp , mmol/L)[25 ] : ...
2
... 采用电子拉力机于室温下测试水凝胶的机械性能, 水凝胶样品宽度为10 mm, 厚度1.5 mm. 将样品以100 mm/min的速度匀速拉断, 测出应力-应变曲线. 其中, 应力(σ , MPa)、 应变(ε , %)、 杨氏模量(E , MPa)和韧性(T , MJ/m3 )分别指断裂压强、 断裂伸长率、 σ⁃ε 曲线弹性区斜率及σ -ε曲线积分面积, 根据滞后实验计算耗散能[24 ] . 借鉴橡胶弹性理论, 利用公式(7 )~(10 )计算水凝胶的交联点之间的相对分子质量(M ¯ c )、 交联密度(ρ c , mol/cm3 )、 网孔尺寸(ξ , nm)及有效交联密度(v exp , mmol/L)[25 ] : ...
... 利用SEM观察了水凝胶的微观结构. 由图5 可见, PVA-CS与PVA-CS-6.16-30均呈现水凝胶典型海绵状多孔结构[26 ] . 但PVA-CS前驱体水凝胶孔径在1.0~4.0 μm之间, 而PVA-CS-6.16-30复合水凝胶的孔径减小至1.0~2.0 μm之间, 网络致密性和均匀性提高[26 ] . SEM结果也得到了理论计算的佐证. 结合溶胀实验和流变实验, 利用式(5 )~(10 )可计算出水凝胶的凝胶分数(F g ,%)、 交联点之间的相对分子质量(M ¯ c )、 交联密度(ρ c , mol/cm3 )、 网孔尺寸(ξ , nm)及有效交联密度(v exp , mmol/L). 结果表明, PVA-CS水凝胶的F g , M ¯ c , ρ c , ξ 和v exp 分别为58.6%, 1650, 7.69×10-4 mol/cm3 , 6.11 nm和5.4 mmol/L, 而PVA-CS-6.16-30的F g , M ¯ c , ρ c , ξ 和v exp 分别为86.8%, 1273, 9.97×10-4 mol/cm3 , 5.21 nm和91.9 mmol/L. F g 和v exp 增加表明网络缺陷(端链、 无效交联点及封闭的链段)减少, 而ξ 和M ¯ c 下降说明网络致密性提高[25 ] , 表明水凝胶机械性能得到了改善. ...
5
... Scheme 1 示出了复合水凝胶PVA-CS-c -t 的构筑过程. 首先将PVA和CS溶于90 ℃去离子水中(PVA和CS的质量分数分别为10%和0.5%)形成透明溶液, 经过3次冻-融循环得到PVA结晶微区交联的前驱体水凝胶PVA-CS. 将其在特定浓度氯化钠水溶液中浸泡一段时间, 诱导CS链发生亲水-疏水转变形成链缠结微区[16 ] 以提高交联密度. 根据霍夫曼序列可知, 氯化钠中的Cl- 是具有盐析效应的离子[26 ] . 通常, 这类离子与聚合物的水化壳层直接相互作用时会降低水-大分子链的相互作用, 增加聚合物/水界面的界面张力, 降低聚合物在水溶液中的溶解度. 因此, 在PVA与CS混合水溶液中加入NaCl颗粒会诱导大分子聚沉(Scheme 1 中样品瓶所示). 当PVA与CS混合溶液经过冻-融循环形成结晶微区交联的前驱体水凝胶PVA-CS时, 三维网络的存在抑制了宏观相分离的发生. 当浸泡于高浓度NaCl水溶液中时, 由于渗透压和盐析效应, 前驱体水凝胶PVA-CS的直径由14.35 mm降低至13.00 mm, 而厚度由5.50 mm缩小至5.00 mm(图S1, 见本文支持信息), 由此可知浸泡后水凝胶体积降低至初始值的75.6%. 体积收缩促使PVA致密化, 有利于结晶[21 ] , 而CS链在NaCl诱导下会形成疏水链缠结微区[16 ] . 二者的协同作用使水凝胶交联密度和网络均匀性增加, 有利于提高机械性能[27 ] . 在高浓度的盐中浸泡虽然能够提高水凝胶的机械性能, 但会打破生命体常规渗透压并造成组织损伤[17 ] . 因此, 最后采用透析方法除去残余NaCl, 得到目标水凝胶PVA-CS-c -t . 如氯化钠浓度为6.16 mol/L, 浸泡时间为30 min时所得复合水凝胶记为PVA-CS-6.16-30. ...
... CS的溶解性与溶液pH值及离子强度有关[16 ] . 例如, Yang等[26 ] 将PAM/CS水凝胶在柠檬酸钠水溶液中浸泡后, 其抗拉强度由0.15 MPa提高到了5.6 MPa. 由于NaCl也是一种具有霍夫曼效应的盐[30 ] , 而PVA/CS复合水凝胶机械性能欠佳[6 ] , 因此采用NaCl水溶液浸泡的方法来提高水凝胶的机械性能. 图S2(见本文支持信息)表明, 当PVA与CS的质量比为100∶5时, 前驱体水凝胶的机械性能最佳. 其 抗拉强度、 断裂伸长率、 拉伸模量、 韧性和抗压强度分别为0.22 MPa, 152%, 0.027 MPa, 0.13 MJ/m3 [图2 (A)]和1.5 MPa[图2 (B)]. 而复合水凝胶PVA-CS-6.16-30的抗拉强度、 断裂伸长率、 拉伸模量、 韧性和抗压强度显著提高至2.9 MPa, 229%, 1.13 MPa, 3.3 MJ/m3 [图2 (A)]和7.6 MPa[图2 (B)]. 此外, 该复合水凝胶还具有优异的抗疲劳特性, 连续压缩10次后其抗压强度依然为初始值的85%[图2 (C)]. 低于100%的可能原因是氢键、 结晶微区及链缠结等交联点的可逆断裂与重组具有依时性[31 ] . 同时, 复合水凝胶PVA-CS-6.16-30还具有良好的抗蠕变性能, 相同作用力下其形变仅为0.42%, 而PVA-CS的形变为0.74%[图2 (D)插图]. 此外, 复合水凝胶PVA-CS-6.16-30的柔量为3.1×10‒5 Pa‒1 , 仅为PVA-CS的10%[图2 (D)], 说明该复合水凝胶具有良好的抗蠕变性能[32 ] . 上述实验证明在NaCl水溶液中浸泡后前驱体水凝胶PVA-CS的机械性能得到了极大的提升. ...
... 利用SEM观察了水凝胶的微观结构. 由图5 可见, PVA-CS与PVA-CS-6.16-30均呈现水凝胶典型海绵状多孔结构[26 ] . 但PVA-CS前驱体水凝胶孔径在1.0~4.0 μm之间, 而PVA-CS-6.16-30复合水凝胶的孔径减小至1.0~2.0 μm之间, 网络致密性和均匀性提高[26 ] . SEM结果也得到了理论计算的佐证. 结合溶胀实验和流变实验, 利用式(5 )~(10 )可计算出水凝胶的凝胶分数(F g ,%)、 交联点之间的相对分子质量(M ¯ c )、 交联密度(ρ c , mol/cm3 )、 网孔尺寸(ξ , nm)及有效交联密度(v exp , mmol/L). 结果表明, PVA-CS水凝胶的F g , M ¯ c , ρ c , ξ 和v exp 分别为58.6%, 1650, 7.69×10-4 mol/cm3 , 6.11 nm和5.4 mmol/L, 而PVA-CS-6.16-30的F g , M ¯ c , ρ c , ξ 和v exp 分别为86.8%, 1273, 9.97×10-4 mol/cm3 , 5.21 nm和91.9 mmol/L. F g 和v exp 增加表明网络缺陷(端链、 无效交联点及封闭的链段)减少, 而ξ 和M ¯ c 下降说明网络致密性提高[25 ] , 表明水凝胶机械性能得到了改善. ...
... [26 ]. SEM结果也得到了理论计算的佐证. 结合溶胀实验和流变实验, 利用式(5 )~(10 )可计算出水凝胶的凝胶分数(F g ,%)、 交联点之间的相对分子质量(M ¯ c )、 交联密度(ρ c , mol/cm3 )、 网孔尺寸(ξ , nm)及有效交联密度(v exp , mmol/L). 结果表明, PVA-CS水凝胶的F g , M ¯ c , ρ c , ξ 和v exp 分别为58.6%, 1650, 7.69×10-4 mol/cm3 , 6.11 nm和5.4 mmol/L, 而PVA-CS-6.16-30的F g , M ¯ c , ρ c , ξ 和v exp 分别为86.8%, 1273, 9.97×10-4 mol/cm3 , 5.21 nm和91.9 mmol/L. F g 和v exp 增加表明网络缺陷(端链、 无效交联点及封闭的链段)减少, 而ξ 和M ¯ c 下降说明网络致密性提高[25 ] , 表明水凝胶机械性能得到了改善. ...
... 由于亲水性侧链以及网络通道的存在, 大部分水凝胶遇水膨胀, 极大限制了其实际应用[1 ,8 ,37 ] . 因此, 借鉴文献[11 ]方法评价了其抗溶胀特性. 由图8 (A)可见, 室温下PVA-CS和PVA-CS-6.16-30两种水凝胶在去离子水中浸泡12 h后, 溶胀度分别为67%和0. 同时, PVA-CS水凝胶的直径由10 mm增加至13 mm, 而PVA-CS-6.16-30的直径几乎不变[图8 (B)]. 由图8 (C)和(D)可见, PVA-CS在去离子水中溶胀平衡后其抗拉强度和断裂伸长率分别衰减至0.05 MPa和90%, 与文献报道值接近[33 ] . 而处于溶胀平衡状态的PVA-CS-6.16-30水凝胶的抗拉和抗压强度依然分别高达2.8和7.5 MPa, 远高于常见抗溶胀水凝胶在千帕范围的抗拉强度[10 ,11 ] , 也优于大多数物理交联水凝胶[38 ] . 因为传统水凝胶内部渗透压高于外部水溶液[39 ,40 ] , 而且其多孔结构有利于水分子扩散, 所以遇水后体积显著膨胀. 而PVA-CS-6.16-30水凝胶中的PVA链在形成结晶微区时处于预拉伸状态, 构象熵较低[41 ] , 而非共价键的协同交联作用进一步降低了网络缺陷[16 ] , 因此具有优异的耐溶胀性能. 将1.0 g PVA-CS-6.16-30水凝胶在100 mL去离子水中浸泡2 d后测得水溶液电导率为1.323 μS/cm, 而去离子水的电导率为1.320 μS/cm(表S1, 见本文支持信息). 根据氯化钠浓度与电导率的标准曲线(y =0.6312x +0.01)计算可知, NaCl残余量为0.012 mg/kg, 远低于205(mmol/kg成人体重)的临界安全浓度[17 ] . Yang等[26 ] 制备的PAM/CS水凝胶及Gao等[42 ] 构筑的PVA/NaCl水凝胶(NaCl含量为78.3 g/kg水凝胶)的生物相容性均已得到细胞实验证实. 考虑到CS和PVA的安全性已经得到FDA认证, 且PVA-CS-6.16-30水凝胶中NaCl含量远低于临界安全浓度, 说明该水凝胶具有较好的生物相容性. 进一步评价了PVA-CS-6.16-30水凝胶在生理环境中的耐溶胀性. 将圆柱形水凝胶在37 ℃的PBS(pH=7.4, c =0.01 mol/L)中浸泡7 d后观察其形状并评价机械性能. 由图9 和图10 可见, 浸泡7 d后该水凝胶初始形状保持不变, 且浸泡过程中样品的抗拉和抗压强度几乎与浸泡前相同, 明显优于常见PVA/CS复合水凝胶体系(表S2, 见本文支持信息). ...
1
... Scheme 1 示出了复合水凝胶PVA-CS-c -t 的构筑过程. 首先将PVA和CS溶于90 ℃去离子水中(PVA和CS的质量分数分别为10%和0.5%)形成透明溶液, 经过3次冻-融循环得到PVA结晶微区交联的前驱体水凝胶PVA-CS. 将其在特定浓度氯化钠水溶液中浸泡一段时间, 诱导CS链发生亲水-疏水转变形成链缠结微区[16 ] 以提高交联密度. 根据霍夫曼序列可知, 氯化钠中的Cl- 是具有盐析效应的离子[26 ] . 通常, 这类离子与聚合物的水化壳层直接相互作用时会降低水-大分子链的相互作用, 增加聚合物/水界面的界面张力, 降低聚合物在水溶液中的溶解度. 因此, 在PVA与CS混合水溶液中加入NaCl颗粒会诱导大分子聚沉(Scheme 1 中样品瓶所示). 当PVA与CS混合溶液经过冻-融循环形成结晶微区交联的前驱体水凝胶PVA-CS时, 三维网络的存在抑制了宏观相分离的发生. 当浸泡于高浓度NaCl水溶液中时, 由于渗透压和盐析效应, 前驱体水凝胶PVA-CS的直径由14.35 mm降低至13.00 mm, 而厚度由5.50 mm缩小至5.00 mm(图S1, 见本文支持信息), 由此可知浸泡后水凝胶体积降低至初始值的75.6%. 体积收缩促使PVA致密化, 有利于结晶[21 ] , 而CS链在NaCl诱导下会形成疏水链缠结微区[16 ] . 二者的协同作用使水凝胶交联密度和网络均匀性增加, 有利于提高机械性能[27 ] . 在高浓度的盐中浸泡虽然能够提高水凝胶的机械性能, 但会打破生命体常规渗透压并造成组织损伤[17 ] . 因此, 最后采用透析方法除去残余NaCl, 得到目标水凝胶PVA-CS-c -t . 如氯化钠浓度为6.16 mol/L, 浸泡时间为30 min时所得复合水凝胶记为PVA-CS-6.16-30. ...
1
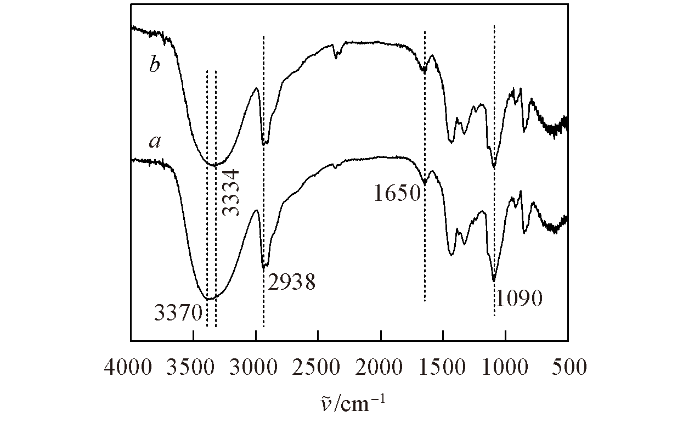
... 图1 给出2种水凝胶的FTIR光谱. 在PVA-CS的FTIR谱图中, 在1090和2938 cm‒1 处分别出现了PVA和CS中C—O和C—H的伸缩振动特征吸收峰[28 ] , 在1650 cm‒1 处出现了CS中C=O的伸缩振动特征吸收峰[29 ] . 在复合水凝胶PVA-CS-6.16-30的FTIR谱中, PVA和CS的上述特征峰均可见, 而且没有其它杂峰, 说明其为物理交联的水凝胶. 此外, PVA-CS-6.16-30水凝胶中活泼氢的特征峰从3370 cm‒1 红移至3334 cm‒1 , 说明PVA与CS形成了更强的氢键[30 ] . ...
1
... 图1 给出2种水凝胶的FTIR光谱. 在PVA-CS的FTIR谱图中, 在1090和2938 cm‒1 处分别出现了PVA和CS中C—O和C—H的伸缩振动特征吸收峰[28 ] , 在1650 cm‒1 处出现了CS中C=O的伸缩振动特征吸收峰[29 ] . 在复合水凝胶PVA-CS-6.16-30的FTIR谱中, PVA和CS的上述特征峰均可见, 而且没有其它杂峰, 说明其为物理交联的水凝胶. 此外, PVA-CS-6.16-30水凝胶中活泼氢的特征峰从3370 cm‒1 红移至3334 cm‒1 , 说明PVA与CS形成了更强的氢键[30 ] . ...
6
... 图1 给出2种水凝胶的FTIR光谱. 在PVA-CS的FTIR谱图中, 在1090和2938 cm‒1 处分别出现了PVA和CS中C—O和C—H的伸缩振动特征吸收峰[28 ] , 在1650 cm‒1 处出现了CS中C=O的伸缩振动特征吸收峰[29 ] . 在复合水凝胶PVA-CS-6.16-30的FTIR谱中, PVA和CS的上述特征峰均可见, 而且没有其它杂峰, 说明其为物理交联的水凝胶. 此外, PVA-CS-6.16-30水凝胶中活泼氢的特征峰从3370 cm‒1 红移至3334 cm‒1 , 说明PVA与CS形成了更强的氢键[30 ] . ...
... CS的溶解性与溶液pH值及离子强度有关[16 ] . 例如, Yang等[26 ] 将PAM/CS水凝胶在柠檬酸钠水溶液中浸泡后, 其抗拉强度由0.15 MPa提高到了5.6 MPa. 由于NaCl也是一种具有霍夫曼效应的盐[30 ] , 而PVA/CS复合水凝胶机械性能欠佳[6 ] , 因此采用NaCl水溶液浸泡的方法来提高水凝胶的机械性能. 图S2(见本文支持信息)表明, 当PVA与CS的质量比为100∶5时, 前驱体水凝胶的机械性能最佳. 其 抗拉强度、 断裂伸长率、 拉伸模量、 韧性和抗压强度分别为0.22 MPa, 152%, 0.027 MPa, 0.13 MJ/m3 [图2 (A)]和1.5 MPa[图2 (B)]. 而复合水凝胶PVA-CS-6.16-30的抗拉强度、 断裂伸长率、 拉伸模量、 韧性和抗压强度显著提高至2.9 MPa, 229%, 1.13 MPa, 3.3 MJ/m3 [图2 (A)]和7.6 MPa[图2 (B)]. 此外, 该复合水凝胶还具有优异的抗疲劳特性, 连续压缩10次后其抗压强度依然为初始值的85%[图2 (C)]. 低于100%的可能原因是氢键、 结晶微区及链缠结等交联点的可逆断裂与重组具有依时性[31 ] . 同时, 复合水凝胶PVA-CS-6.16-30还具有良好的抗蠕变性能, 相同作用力下其形变仅为0.42%, 而PVA-CS的形变为0.74%[图2 (D)插图]. 此外, 复合水凝胶PVA-CS-6.16-30的柔量为3.1×10‒5 Pa‒1 , 仅为PVA-CS的10%[图2 (D)], 说明该复合水凝胶具有良好的抗蠕变性能[32 ] . 上述实验证明在NaCl水溶液中浸泡后前驱体水凝胶PVA-CS的机械性能得到了极大的提升. ...
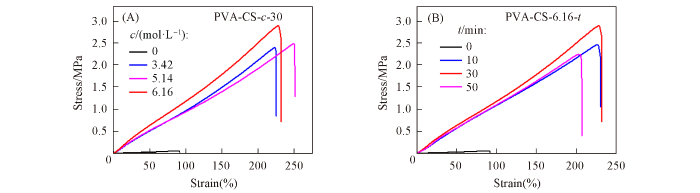
... 进一步考察了氯化钠浓度和浸泡时间对复合水凝胶PVA-CS-c -t 拉伸性能的影响(图3 ). 可以看出, 将水凝胶前驱体在去离子水中浸泡30 min后, 其抗拉强度和断裂伸长率衰减至0.05 MPa和90%, 与文献[33 ]报道值接近. 然而将其在浓度为3.42, 5.14和6.16 mol/L的NaCl水溶液中浸泡30 min并透析2 d后, 其抗拉强度显著增加至2.4, 2.5和2.9 MPa, 而断裂伸长率分别为223%和250%和229%. 随后固定NaCl的摩尔浓度为6.16 mol/L, 研究了浸泡时间对水凝胶拉伸性能的影响. 可以看出, 当浸泡时间由10 min增加至30 min时, 其抗拉强度和断裂伸长率分别由2.5 MPa和226%增加至2.9 MPa和229%; 继续延长浸泡时间至50 min, 其抗拉强度和断裂伸长率开始下降. 这是由于CS链缠结微区在水凝胶网络中也充当交联点, 浸泡时间过短时水凝胶网络不够完善, 而浸泡时间过长时可能引起过度交联[30 ] . ...
... 水凝胶的机械性能与含水率、 微观结构以及交联特点有关[30 ,33 ,34 ] . 由称重法利用式(1) 可知PVA-CS和PVA-CS-6.16-30的含水率分别为89.1%和81.9%. 通常, 含水率下降, 水凝胶机械性能提升. 为阐明PVA-CS-6.16-30的增强机理, 将17.24 g PVA和0.86 g CS溶于81.9 g去离子水中, 并经过3次冻-融循环制备了参比水凝胶, 其组成及含量与复合水凝胶PVA-CS-6.16-30一致. 拉力机测试结果表明其抗拉强度和抗压强度仅为0.54 MPa和1.6 MPa(图S3, 见本文支持信息). 尽管两种水凝胶中PVA, CS及水含量完全相同, 但PVA-CS-6.16-30抗拉强度和抗压强度是参比水凝胶的5.4和4.8倍, 说明含水率下降不是PVA-CS-6.16-30机械性能提升的主要原因. 这是因为, 水凝胶的机械性能不仅取决于聚合物组成和质量分数, 还与结晶微区和相分离程度等微观结构以及交联特点有关[21 ,34 ] . ...
... 综合上述实验提出如下增强机理: PVA链在冻-融循环中形成的结晶微区构成了水凝胶的初级交联点. 由于冻-融循环时结晶微区无序形成和生长, 且不具备高效的能量耗散机制[36 ] , 所以单网络PVA水凝胶的抗拉强度仅为0.15 MPa. 而借鉴双网络设计理念[7 ] 在PVA水溶液中加入少量CS(5%), 可将前驱体水凝胶PVA-CS的抗拉强度增加至0.22 MPa(图S2, 见本文支持信息). 由于PVA与CS之间的氢键较强, 有利于CS分子链均匀分布在黏性PVA三维网络中. 当在高浓度NaCl水溶液中浸泡时, 由于渗透压作用, 水凝胶体积收缩, 使PVA结晶度由14.8%增加至17.2%, 同时含水率由89.1%降低至81.9%. 尤为重要的是, Cl- 的霍夫曼效应降低了PVA和CS与水分子之间的相互作用, 增加了聚合物/水界面的界面张力[30 ] , 导致大分子链水溶性降低, 从而沉淀在样品瓶底部(Scheme 1 ). 水凝胶三维网络的受限空间抑制了宏观相分离的发生 [30 ] , 因此CS链在凝胶网络内形成链缠结疏水微区[16 ] . 由于CS链缠结微区在非酸性水溶液中十分稳定[19 ] , 将盐水替换为去离子水并搅拌后CS溶液依然浑浊(图S5, 见本文支持信息). 因此, 用去离子水透析2 d除去残余NaCl时大部分CS链依然以链缠结微区形式充当交联点[16 ] , 而PVA的水合作用使水凝胶体积增加至透析前的1.24倍(图S6, 见本文支持信息). 上述作用增加了水凝胶交联密度, 并有效减少了端链、 无效交联点及封闭的链段等网络缺陷. 与PVA-CS水凝胶相比, PVA-CS-6.16-30水凝胶的交联密度由7.69×10-4 mol/cm3 增加至9.97×10-4 mol/cm3 , 网孔尺寸由 6.11 nm降低至5.21 nm, 凝胶分数由58.6%增加至86.8%, 网络均匀性和致密性提高. 此外, 自由水含量由62.8%降低至52.6%, 水凝胶内摩擦力和黏弹性增加. 而氢键和疏水微区等非共价键在外力下的可逆断裂与重组耗散了大量能量, 使PVA-CS-6.16-30水凝胶的抗拉强度显著增加至2.9 MPa. 由于PVA结晶微区融化温度在70 ℃附近[18 ] , 而CS链缠结微区在非酸性水溶液中十分稳定[19 ] , 有望赋予PVA-CS-6.16-30水凝胶抗溶胀性能. ...
... [30 ], 因此CS链在凝胶网络内形成链缠结疏水微区[16 ] . 由于CS链缠结微区在非酸性水溶液中十分稳定[19 ] , 将盐水替换为去离子水并搅拌后CS溶液依然浑浊(图S5, 见本文支持信息). 因此, 用去离子水透析2 d除去残余NaCl时大部分CS链依然以链缠结微区形式充当交联点[16 ] , 而PVA的水合作用使水凝胶体积增加至透析前的1.24倍(图S6, 见本文支持信息). 上述作用增加了水凝胶交联密度, 并有效减少了端链、 无效交联点及封闭的链段等网络缺陷. 与PVA-CS水凝胶相比, PVA-CS-6.16-30水凝胶的交联密度由7.69×10-4 mol/cm3 增加至9.97×10-4 mol/cm3 , 网孔尺寸由 6.11 nm降低至5.21 nm, 凝胶分数由58.6%增加至86.8%, 网络均匀性和致密性提高. 此外, 自由水含量由62.8%降低至52.6%, 水凝胶内摩擦力和黏弹性增加. 而氢键和疏水微区等非共价键在外力下的可逆断裂与重组耗散了大量能量, 使PVA-CS-6.16-30水凝胶的抗拉强度显著增加至2.9 MPa. 由于PVA结晶微区融化温度在70 ℃附近[18 ] , 而CS链缠结微区在非酸性水溶液中十分稳定[19 ] , 有望赋予PVA-CS-6.16-30水凝胶抗溶胀性能. ...
2
... CS的溶解性与溶液pH值及离子强度有关[16 ] . 例如, Yang等[26 ] 将PAM/CS水凝胶在柠檬酸钠水溶液中浸泡后, 其抗拉强度由0.15 MPa提高到了5.6 MPa. 由于NaCl也是一种具有霍夫曼效应的盐[30 ] , 而PVA/CS复合水凝胶机械性能欠佳[6 ] , 因此采用NaCl水溶液浸泡的方法来提高水凝胶的机械性能. 图S2(见本文支持信息)表明, 当PVA与CS的质量比为100∶5时, 前驱体水凝胶的机械性能最佳. 其 抗拉强度、 断裂伸长率、 拉伸模量、 韧性和抗压强度分别为0.22 MPa, 152%, 0.027 MPa, 0.13 MJ/m3 [图2 (A)]和1.5 MPa[图2 (B)]. 而复合水凝胶PVA-CS-6.16-30的抗拉强度、 断裂伸长率、 拉伸模量、 韧性和抗压强度显著提高至2.9 MPa, 229%, 1.13 MPa, 3.3 MJ/m3 [图2 (A)]和7.6 MPa[图2 (B)]. 此外, 该复合水凝胶还具有优异的抗疲劳特性, 连续压缩10次后其抗压强度依然为初始值的85%[图2 (C)]. 低于100%的可能原因是氢键、 结晶微区及链缠结等交联点的可逆断裂与重组具有依时性[31 ] . 同时, 复合水凝胶PVA-CS-6.16-30还具有良好的抗蠕变性能, 相同作用力下其形变仅为0.42%, 而PVA-CS的形变为0.74%[图2 (D)插图]. 此外, 复合水凝胶PVA-CS-6.16-30的柔量为3.1×10‒5 Pa‒1 , 仅为PVA-CS的10%[图2 (D)], 说明该复合水凝胶具有良好的抗蠕变性能[32 ] . 上述实验证明在NaCl水溶液中浸泡后前驱体水凝胶PVA-CS的机械性能得到了极大的提升. ...
... 进一步通过滞后实验研究了水凝胶的能量耗散机制[31 ] . 由图6 可见, 尽管两种水凝胶均具有 滞后环, 但100%应变下PVA-CS-6.16-30水凝胶的耗散能是PVA-CS水凝胶的14倍. 说明浸泡过程所形成的CS链缠结微区能够更有效地耗散外力, 从而提高水凝胶的机械性能. 此外, PVA-CS-6.16-30 水凝胶在应变为50%, 100%, 150%和200%时的耗散能分别为0.07, 0.29, 0.75和1.41 MJ/m3 , 能量耗散效率分别为63.6%, 67.4%, 78.9%和84.4%. 这是由于CS的链缠结作用增强了水凝胶的能量耗散效率. ...
1
... CS的溶解性与溶液pH值及离子强度有关[16 ] . 例如, Yang等[26 ] 将PAM/CS水凝胶在柠檬酸钠水溶液中浸泡后, 其抗拉强度由0.15 MPa提高到了5.6 MPa. 由于NaCl也是一种具有霍夫曼效应的盐[30 ] , 而PVA/CS复合水凝胶机械性能欠佳[6 ] , 因此采用NaCl水溶液浸泡的方法来提高水凝胶的机械性能. 图S2(见本文支持信息)表明, 当PVA与CS的质量比为100∶5时, 前驱体水凝胶的机械性能最佳. 其 抗拉强度、 断裂伸长率、 拉伸模量、 韧性和抗压强度分别为0.22 MPa, 152%, 0.027 MPa, 0.13 MJ/m3 [图2 (A)]和1.5 MPa[图2 (B)]. 而复合水凝胶PVA-CS-6.16-30的抗拉强度、 断裂伸长率、 拉伸模量、 韧性和抗压强度显著提高至2.9 MPa, 229%, 1.13 MPa, 3.3 MJ/m3 [图2 (A)]和7.6 MPa[图2 (B)]. 此外, 该复合水凝胶还具有优异的抗疲劳特性, 连续压缩10次后其抗压强度依然为初始值的85%[图2 (C)]. 低于100%的可能原因是氢键、 结晶微区及链缠结等交联点的可逆断裂与重组具有依时性[31 ] . 同时, 复合水凝胶PVA-CS-6.16-30还具有良好的抗蠕变性能, 相同作用力下其形变仅为0.42%, 而PVA-CS的形变为0.74%[图2 (D)插图]. 此外, 复合水凝胶PVA-CS-6.16-30的柔量为3.1×10‒5 Pa‒1 , 仅为PVA-CS的10%[图2 (D)], 说明该复合水凝胶具有良好的抗蠕变性能[32 ] . 上述实验证明在NaCl水溶液中浸泡后前驱体水凝胶PVA-CS的机械性能得到了极大的提升. ...
3
... 进一步考察了氯化钠浓度和浸泡时间对复合水凝胶PVA-CS-c -t 拉伸性能的影响(图3 ). 可以看出, 将水凝胶前驱体在去离子水中浸泡30 min后, 其抗拉强度和断裂伸长率衰减至0.05 MPa和90%, 与文献[33 ]报道值接近. 然而将其在浓度为3.42, 5.14和6.16 mol/L的NaCl水溶液中浸泡30 min并透析2 d后, 其抗拉强度显著增加至2.4, 2.5和2.9 MPa, 而断裂伸长率分别为223%和250%和229%. 随后固定NaCl的摩尔浓度为6.16 mol/L, 研究了浸泡时间对水凝胶拉伸性能的影响. 可以看出, 当浸泡时间由10 min增加至30 min时, 其抗拉强度和断裂伸长率分别由2.5 MPa和226%增加至2.9 MPa和229%; 继续延长浸泡时间至50 min, 其抗拉强度和断裂伸长率开始下降. 这是由于CS链缠结微区在水凝胶网络中也充当交联点, 浸泡时间过短时水凝胶网络不够完善, 而浸泡时间过长时可能引起过度交联[30 ] . ...
... 水凝胶的机械性能与含水率、 微观结构以及交联特点有关[30 ,33 ,34 ] . 由称重法利用式(1) 可知PVA-CS和PVA-CS-6.16-30的含水率分别为89.1%和81.9%. 通常, 含水率下降, 水凝胶机械性能提升. 为阐明PVA-CS-6.16-30的增强机理, 将17.24 g PVA和0.86 g CS溶于81.9 g去离子水中, 并经过3次冻-融循环制备了参比水凝胶, 其组成及含量与复合水凝胶PVA-CS-6.16-30一致. 拉力机测试结果表明其抗拉强度和抗压强度仅为0.54 MPa和1.6 MPa(图S3, 见本文支持信息). 尽管两种水凝胶中PVA, CS及水含量完全相同, 但PVA-CS-6.16-30抗拉强度和抗压强度是参比水凝胶的5.4和4.8倍, 说明含水率下降不是PVA-CS-6.16-30机械性能提升的主要原因. 这是因为, 水凝胶的机械性能不仅取决于聚合物组成和质量分数, 还与结晶微区和相分离程度等微观结构以及交联特点有关[21 ,34 ] . ...
... 由于亲水性侧链以及网络通道的存在, 大部分水凝胶遇水膨胀, 极大限制了其实际应用[1 ,8 ,37 ] . 因此, 借鉴文献[11 ]方法评价了其抗溶胀特性. 由图8 (A)可见, 室温下PVA-CS和PVA-CS-6.16-30两种水凝胶在去离子水中浸泡12 h后, 溶胀度分别为67%和0. 同时, PVA-CS水凝胶的直径由10 mm增加至13 mm, 而PVA-CS-6.16-30的直径几乎不变[图8 (B)]. 由图8 (C)和(D)可见, PVA-CS在去离子水中溶胀平衡后其抗拉强度和断裂伸长率分别衰减至0.05 MPa和90%, 与文献报道值接近[33 ] . 而处于溶胀平衡状态的PVA-CS-6.16-30水凝胶的抗拉和抗压强度依然分别高达2.8和7.5 MPa, 远高于常见抗溶胀水凝胶在千帕范围的抗拉强度[10 ,11 ] , 也优于大多数物理交联水凝胶[38 ] . 因为传统水凝胶内部渗透压高于外部水溶液[39 ,40 ] , 而且其多孔结构有利于水分子扩散, 所以遇水后体积显著膨胀. 而PVA-CS-6.16-30水凝胶中的PVA链在形成结晶微区时处于预拉伸状态, 构象熵较低[41 ] , 而非共价键的协同交联作用进一步降低了网络缺陷[16 ] , 因此具有优异的耐溶胀性能. 将1.0 g PVA-CS-6.16-30水凝胶在100 mL去离子水中浸泡2 d后测得水溶液电导率为1.323 μS/cm, 而去离子水的电导率为1.320 μS/cm(表S1, 见本文支持信息). 根据氯化钠浓度与电导率的标准曲线(y =0.6312x +0.01)计算可知, NaCl残余量为0.012 mg/kg, 远低于205(mmol/kg成人体重)的临界安全浓度[17 ] . Yang等[26 ] 制备的PAM/CS水凝胶及Gao等[42 ] 构筑的PVA/NaCl水凝胶(NaCl含量为78.3 g/kg水凝胶)的生物相容性均已得到细胞实验证实. 考虑到CS和PVA的安全性已经得到FDA认证, 且PVA-CS-6.16-30水凝胶中NaCl含量远低于临界安全浓度, 说明该水凝胶具有较好的生物相容性. 进一步评价了PVA-CS-6.16-30水凝胶在生理环境中的耐溶胀性. 将圆柱形水凝胶在37 ℃的PBS(pH=7.4, c =0.01 mol/L)中浸泡7 d后观察其形状并评价机械性能. 由图9 和图10 可见, 浸泡7 d后该水凝胶初始形状保持不变, 且浸泡过程中样品的抗拉和抗压强度几乎与浸泡前相同, 明显优于常见PVA/CS复合水凝胶体系(表S2, 见本文支持信息). ...
2
... 水凝胶的机械性能与含水率、 微观结构以及交联特点有关[30 ,33 ,34 ] . 由称重法利用式(1) 可知PVA-CS和PVA-CS-6.16-30的含水率分别为89.1%和81.9%. 通常, 含水率下降, 水凝胶机械性能提升. 为阐明PVA-CS-6.16-30的增强机理, 将17.24 g PVA和0.86 g CS溶于81.9 g去离子水中, 并经过3次冻-融循环制备了参比水凝胶, 其组成及含量与复合水凝胶PVA-CS-6.16-30一致. 拉力机测试结果表明其抗拉强度和抗压强度仅为0.54 MPa和1.6 MPa(图S3, 见本文支持信息). 尽管两种水凝胶中PVA, CS及水含量完全相同, 但PVA-CS-6.16-30抗拉强度和抗压强度是参比水凝胶的5.4和4.8倍, 说明含水率下降不是PVA-CS-6.16-30机械性能提升的主要原因. 这是因为, 水凝胶的机械性能不仅取决于聚合物组成和质量分数, 还与结晶微区和相分离程度等微观结构以及交联特点有关[21 ,34 ] . ...
... ,34 ]. ...
1
... 结合DSC、 XRD、 SEM及流变分析揭示了水凝胶的微观结构. 首先, 利用DSC[6 ] 测试了PVA-CS和PVA-CS-6.16-30水凝胶中自由水与结合水的含量[图4 (A)]. PVA-CS在1.5 ℃处出现了自由水的吸热峰[6 ] , 其熔融焓为209.4 J/g, 由式(2) 可计算出自由水质量分数为62.8%, 由总含水量(89.1%)减去自由水含量可知结合水含量为26.3%. 而PVA-CS-6.16-30中自由水的熔融焓降低至175.4 J/g, 由式(2) 可知自由水含量为52.6%. 由总含水量(81.9%)减去自由水含量可知结合水含量为 29.3%. 通常自由水含量降低, 水凝胶内摩擦阻力增加[35 ] . 采用XRD分析了原料PVA与CS的结晶度(图S4, 见本文支持信息). 可见, 原料CS没有明显衍射峰, 说明CS粉末中不存在晶体结构[16 ] ; 而PVA粉末在2θ 值为19.6°处出现了较强的特征衍射峰, 对应PVA的(101)晶面[21 ] . 由2θ 值为18°~21°之间的积分面积(1284.9)除以衍射曲线下方总面积(8988.3), 利用式(3) 可计算出PVA粉末的结晶度等于14.3%. 进一步利用XRD分析了后处理对水凝胶中PVA结晶度的影响. 由图4 (B)可见, 两种水凝胶在2θ 值为 18°~21°之间均出现了PVA的(101)晶面的特征衍射峰[21 ] , 利用式(3) 可计算出PVA结晶度. 结果表明, 后处理使PVA结晶度由14.8%增加至17.2%[21 ] . 这是因为NaCl浸泡过程中水凝胶体积收缩, PVA排列更紧密, 有利于结晶[21 ] . 通常, 自由含水率下降, 结晶度增加, 材料机械性能会提高[18 ] . ...
1
... 综合上述实验提出如下增强机理: PVA链在冻-融循环中形成的结晶微区构成了水凝胶的初级交联点. 由于冻-融循环时结晶微区无序形成和生长, 且不具备高效的能量耗散机制[36 ] , 所以单网络PVA水凝胶的抗拉强度仅为0.15 MPa. 而借鉴双网络设计理念[7 ] 在PVA水溶液中加入少量CS(5%), 可将前驱体水凝胶PVA-CS的抗拉强度增加至0.22 MPa(图S2, 见本文支持信息). 由于PVA与CS之间的氢键较强, 有利于CS分子链均匀分布在黏性PVA三维网络中. 当在高浓度NaCl水溶液中浸泡时, 由于渗透压作用, 水凝胶体积收缩, 使PVA结晶度由14.8%增加至17.2%, 同时含水率由89.1%降低至81.9%. 尤为重要的是, Cl- 的霍夫曼效应降低了PVA和CS与水分子之间的相互作用, 增加了聚合物/水界面的界面张力[30 ] , 导致大分子链水溶性降低, 从而沉淀在样品瓶底部(Scheme 1 ). 水凝胶三维网络的受限空间抑制了宏观相分离的发生 [30 ] , 因此CS链在凝胶网络内形成链缠结疏水微区[16 ] . 由于CS链缠结微区在非酸性水溶液中十分稳定[19 ] , 将盐水替换为去离子水并搅拌后CS溶液依然浑浊(图S5, 见本文支持信息). 因此, 用去离子水透析2 d除去残余NaCl时大部分CS链依然以链缠结微区形式充当交联点[16 ] , 而PVA的水合作用使水凝胶体积增加至透析前的1.24倍(图S6, 见本文支持信息). 上述作用增加了水凝胶交联密度, 并有效减少了端链、 无效交联点及封闭的链段等网络缺陷. 与PVA-CS水凝胶相比, PVA-CS-6.16-30水凝胶的交联密度由7.69×10-4 mol/cm3 增加至9.97×10-4 mol/cm3 , 网孔尺寸由 6.11 nm降低至5.21 nm, 凝胶分数由58.6%增加至86.8%, 网络均匀性和致密性提高. 此外, 自由水含量由62.8%降低至52.6%, 水凝胶内摩擦力和黏弹性增加. 而氢键和疏水微区等非共价键在外力下的可逆断裂与重组耗散了大量能量, 使PVA-CS-6.16-30水凝胶的抗拉强度显著增加至2.9 MPa. 由于PVA结晶微区融化温度在70 ℃附近[18 ] , 而CS链缠结微区在非酸性水溶液中十分稳定[19 ] , 有望赋予PVA-CS-6.16-30水凝胶抗溶胀性能. ...
1
... 由于亲水性侧链以及网络通道的存在, 大部分水凝胶遇水膨胀, 极大限制了其实际应用[1 ,8 ,37 ] . 因此, 借鉴文献[11 ]方法评价了其抗溶胀特性. 由图8 (A)可见, 室温下PVA-CS和PVA-CS-6.16-30两种水凝胶在去离子水中浸泡12 h后, 溶胀度分别为67%和0. 同时, PVA-CS水凝胶的直径由10 mm增加至13 mm, 而PVA-CS-6.16-30的直径几乎不变[图8 (B)]. 由图8 (C)和(D)可见, PVA-CS在去离子水中溶胀平衡后其抗拉强度和断裂伸长率分别衰减至0.05 MPa和90%, 与文献报道值接近[33 ] . 而处于溶胀平衡状态的PVA-CS-6.16-30水凝胶的抗拉和抗压强度依然分别高达2.8和7.5 MPa, 远高于常见抗溶胀水凝胶在千帕范围的抗拉强度[10 ,11 ] , 也优于大多数物理交联水凝胶[38 ] . 因为传统水凝胶内部渗透压高于外部水溶液[39 ,40 ] , 而且其多孔结构有利于水分子扩散, 所以遇水后体积显著膨胀. 而PVA-CS-6.16-30水凝胶中的PVA链在形成结晶微区时处于预拉伸状态, 构象熵较低[41 ] , 而非共价键的协同交联作用进一步降低了网络缺陷[16 ] , 因此具有优异的耐溶胀性能. 将1.0 g PVA-CS-6.16-30水凝胶在100 mL去离子水中浸泡2 d后测得水溶液电导率为1.323 μS/cm, 而去离子水的电导率为1.320 μS/cm(表S1, 见本文支持信息). 根据氯化钠浓度与电导率的标准曲线(y =0.6312x +0.01)计算可知, NaCl残余量为0.012 mg/kg, 远低于205(mmol/kg成人体重)的临界安全浓度[17 ] . Yang等[26 ] 制备的PAM/CS水凝胶及Gao等[42 ] 构筑的PVA/NaCl水凝胶(NaCl含量为78.3 g/kg水凝胶)的生物相容性均已得到细胞实验证实. 考虑到CS和PVA的安全性已经得到FDA认证, 且PVA-CS-6.16-30水凝胶中NaCl含量远低于临界安全浓度, 说明该水凝胶具有较好的生物相容性. 进一步评价了PVA-CS-6.16-30水凝胶在生理环境中的耐溶胀性. 将圆柱形水凝胶在37 ℃的PBS(pH=7.4, c =0.01 mol/L)中浸泡7 d后观察其形状并评价机械性能. 由图9 和图10 可见, 浸泡7 d后该水凝胶初始形状保持不变, 且浸泡过程中样品的抗拉和抗压强度几乎与浸泡前相同, 明显优于常见PVA/CS复合水凝胶体系(表S2, 见本文支持信息). ...
1
... 由于亲水性侧链以及网络通道的存在, 大部分水凝胶遇水膨胀, 极大限制了其实际应用[1 ,8 ,37 ] . 因此, 借鉴文献[11 ]方法评价了其抗溶胀特性. 由图8 (A)可见, 室温下PVA-CS和PVA-CS-6.16-30两种水凝胶在去离子水中浸泡12 h后, 溶胀度分别为67%和0. 同时, PVA-CS水凝胶的直径由10 mm增加至13 mm, 而PVA-CS-6.16-30的直径几乎不变[图8 (B)]. 由图8 (C)和(D)可见, PVA-CS在去离子水中溶胀平衡后其抗拉强度和断裂伸长率分别衰减至0.05 MPa和90%, 与文献报道值接近[33 ] . 而处于溶胀平衡状态的PVA-CS-6.16-30水凝胶的抗拉和抗压强度依然分别高达2.8和7.5 MPa, 远高于常见抗溶胀水凝胶在千帕范围的抗拉强度[10 ,11 ] , 也优于大多数物理交联水凝胶[38 ] . 因为传统水凝胶内部渗透压高于外部水溶液[39 ,40 ] , 而且其多孔结构有利于水分子扩散, 所以遇水后体积显著膨胀. 而PVA-CS-6.16-30水凝胶中的PVA链在形成结晶微区时处于预拉伸状态, 构象熵较低[41 ] , 而非共价键的协同交联作用进一步降低了网络缺陷[16 ] , 因此具有优异的耐溶胀性能. 将1.0 g PVA-CS-6.16-30水凝胶在100 mL去离子水中浸泡2 d后测得水溶液电导率为1.323 μS/cm, 而去离子水的电导率为1.320 μS/cm(表S1, 见本文支持信息). 根据氯化钠浓度与电导率的标准曲线(y =0.6312x +0.01)计算可知, NaCl残余量为0.012 mg/kg, 远低于205(mmol/kg成人体重)的临界安全浓度[17 ] . Yang等[26 ] 制备的PAM/CS水凝胶及Gao等[42 ] 构筑的PVA/NaCl水凝胶(NaCl含量为78.3 g/kg水凝胶)的生物相容性均已得到细胞实验证实. 考虑到CS和PVA的安全性已经得到FDA认证, 且PVA-CS-6.16-30水凝胶中NaCl含量远低于临界安全浓度, 说明该水凝胶具有较好的生物相容性. 进一步评价了PVA-CS-6.16-30水凝胶在生理环境中的耐溶胀性. 将圆柱形水凝胶在37 ℃的PBS(pH=7.4, c =0.01 mol/L)中浸泡7 d后观察其形状并评价机械性能. 由图9 和图10 可见, 浸泡7 d后该水凝胶初始形状保持不变, 且浸泡过程中样品的抗拉和抗压强度几乎与浸泡前相同, 明显优于常见PVA/CS复合水凝胶体系(表S2, 见本文支持信息). ...
1
... 由于亲水性侧链以及网络通道的存在, 大部分水凝胶遇水膨胀, 极大限制了其实际应用[1 ,8 ,37 ] . 因此, 借鉴文献[11 ]方法评价了其抗溶胀特性. 由图8 (A)可见, 室温下PVA-CS和PVA-CS-6.16-30两种水凝胶在去离子水中浸泡12 h后, 溶胀度分别为67%和0. 同时, PVA-CS水凝胶的直径由10 mm增加至13 mm, 而PVA-CS-6.16-30的直径几乎不变[图8 (B)]. 由图8 (C)和(D)可见, PVA-CS在去离子水中溶胀平衡后其抗拉强度和断裂伸长率分别衰减至0.05 MPa和90%, 与文献报道值接近[33 ] . 而处于溶胀平衡状态的PVA-CS-6.16-30水凝胶的抗拉和抗压强度依然分别高达2.8和7.5 MPa, 远高于常见抗溶胀水凝胶在千帕范围的抗拉强度[10 ,11 ] , 也优于大多数物理交联水凝胶[38 ] . 因为传统水凝胶内部渗透压高于外部水溶液[39 ,40 ] , 而且其多孔结构有利于水分子扩散, 所以遇水后体积显著膨胀. 而PVA-CS-6.16-30水凝胶中的PVA链在形成结晶微区时处于预拉伸状态, 构象熵较低[41 ] , 而非共价键的协同交联作用进一步降低了网络缺陷[16 ] , 因此具有优异的耐溶胀性能. 将1.0 g PVA-CS-6.16-30水凝胶在100 mL去离子水中浸泡2 d后测得水溶液电导率为1.323 μS/cm, 而去离子水的电导率为1.320 μS/cm(表S1, 见本文支持信息). 根据氯化钠浓度与电导率的标准曲线(y =0.6312x +0.01)计算可知, NaCl残余量为0.012 mg/kg, 远低于205(mmol/kg成人体重)的临界安全浓度[17 ] . Yang等[26 ] 制备的PAM/CS水凝胶及Gao等[42 ] 构筑的PVA/NaCl水凝胶(NaCl含量为78.3 g/kg水凝胶)的生物相容性均已得到细胞实验证实. 考虑到CS和PVA的安全性已经得到FDA认证, 且PVA-CS-6.16-30水凝胶中NaCl含量远低于临界安全浓度, 说明该水凝胶具有较好的生物相容性. 进一步评价了PVA-CS-6.16-30水凝胶在生理环境中的耐溶胀性. 将圆柱形水凝胶在37 ℃的PBS(pH=7.4, c =0.01 mol/L)中浸泡7 d后观察其形状并评价机械性能. 由图9 和图10 可见, 浸泡7 d后该水凝胶初始形状保持不变, 且浸泡过程中样品的抗拉和抗压强度几乎与浸泡前相同, 明显优于常见PVA/CS复合水凝胶体系(表S2, 见本文支持信息). ...
1
... 由于亲水性侧链以及网络通道的存在, 大部分水凝胶遇水膨胀, 极大限制了其实际应用[1 ,8 ,37 ] . 因此, 借鉴文献[11 ]方法评价了其抗溶胀特性. 由图8 (A)可见, 室温下PVA-CS和PVA-CS-6.16-30两种水凝胶在去离子水中浸泡12 h后, 溶胀度分别为67%和0. 同时, PVA-CS水凝胶的直径由10 mm增加至13 mm, 而PVA-CS-6.16-30的直径几乎不变[图8 (B)]. 由图8 (C)和(D)可见, PVA-CS在去离子水中溶胀平衡后其抗拉强度和断裂伸长率分别衰减至0.05 MPa和90%, 与文献报道值接近[33 ] . 而处于溶胀平衡状态的PVA-CS-6.16-30水凝胶的抗拉和抗压强度依然分别高达2.8和7.5 MPa, 远高于常见抗溶胀水凝胶在千帕范围的抗拉强度[10 ,11 ] , 也优于大多数物理交联水凝胶[38 ] . 因为传统水凝胶内部渗透压高于外部水溶液[39 ,40 ] , 而且其多孔结构有利于水分子扩散, 所以遇水后体积显著膨胀. 而PVA-CS-6.16-30水凝胶中的PVA链在形成结晶微区时处于预拉伸状态, 构象熵较低[41 ] , 而非共价键的协同交联作用进一步降低了网络缺陷[16 ] , 因此具有优异的耐溶胀性能. 将1.0 g PVA-CS-6.16-30水凝胶在100 mL去离子水中浸泡2 d后测得水溶液电导率为1.323 μS/cm, 而去离子水的电导率为1.320 μS/cm(表S1, 见本文支持信息). 根据氯化钠浓度与电导率的标准曲线(y =0.6312x +0.01)计算可知, NaCl残余量为0.012 mg/kg, 远低于205(mmol/kg成人体重)的临界安全浓度[17 ] . Yang等[26 ] 制备的PAM/CS水凝胶及Gao等[42 ] 构筑的PVA/NaCl水凝胶(NaCl含量为78.3 g/kg水凝胶)的生物相容性均已得到细胞实验证实. 考虑到CS和PVA的安全性已经得到FDA认证, 且PVA-CS-6.16-30水凝胶中NaCl含量远低于临界安全浓度, 说明该水凝胶具有较好的生物相容性. 进一步评价了PVA-CS-6.16-30水凝胶在生理环境中的耐溶胀性. 将圆柱形水凝胶在37 ℃的PBS(pH=7.4, c =0.01 mol/L)中浸泡7 d后观察其形状并评价机械性能. 由图9 和图10 可见, 浸泡7 d后该水凝胶初始形状保持不变, 且浸泡过程中样品的抗拉和抗压强度几乎与浸泡前相同, 明显优于常见PVA/CS复合水凝胶体系(表S2, 见本文支持信息). ...
1
... 由于亲水性侧链以及网络通道的存在, 大部分水凝胶遇水膨胀, 极大限制了其实际应用[1 ,8 ,37 ] . 因此, 借鉴文献[11 ]方法评价了其抗溶胀特性. 由图8 (A)可见, 室温下PVA-CS和PVA-CS-6.16-30两种水凝胶在去离子水中浸泡12 h后, 溶胀度分别为67%和0. 同时, PVA-CS水凝胶的直径由10 mm增加至13 mm, 而PVA-CS-6.16-30的直径几乎不变[图8 (B)]. 由图8 (C)和(D)可见, PVA-CS在去离子水中溶胀平衡后其抗拉强度和断裂伸长率分别衰减至0.05 MPa和90%, 与文献报道值接近[33 ] . 而处于溶胀平衡状态的PVA-CS-6.16-30水凝胶的抗拉和抗压强度依然分别高达2.8和7.5 MPa, 远高于常见抗溶胀水凝胶在千帕范围的抗拉强度[10 ,11 ] , 也优于大多数物理交联水凝胶[38 ] . 因为传统水凝胶内部渗透压高于外部水溶液[39 ,40 ] , 而且其多孔结构有利于水分子扩散, 所以遇水后体积显著膨胀. 而PVA-CS-6.16-30水凝胶中的PVA链在形成结晶微区时处于预拉伸状态, 构象熵较低[41 ] , 而非共价键的协同交联作用进一步降低了网络缺陷[16 ] , 因此具有优异的耐溶胀性能. 将1.0 g PVA-CS-6.16-30水凝胶在100 mL去离子水中浸泡2 d后测得水溶液电导率为1.323 μS/cm, 而去离子水的电导率为1.320 μS/cm(表S1, 见本文支持信息). 根据氯化钠浓度与电导率的标准曲线(y =0.6312x +0.01)计算可知, NaCl残余量为0.012 mg/kg, 远低于205(mmol/kg成人体重)的临界安全浓度[17 ] . Yang等[26 ] 制备的PAM/CS水凝胶及Gao等[42 ] 构筑的PVA/NaCl水凝胶(NaCl含量为78.3 g/kg水凝胶)的生物相容性均已得到细胞实验证实. 考虑到CS和PVA的安全性已经得到FDA认证, 且PVA-CS-6.16-30水凝胶中NaCl含量远低于临界安全浓度, 说明该水凝胶具有较好的生物相容性. 进一步评价了PVA-CS-6.16-30水凝胶在生理环境中的耐溶胀性. 将圆柱形水凝胶在37 ℃的PBS(pH=7.4, c =0.01 mol/L)中浸泡7 d后观察其形状并评价机械性能. 由图9 和图10 可见, 浸泡7 d后该水凝胶初始形状保持不变, 且浸泡过程中样品的抗拉和抗压强度几乎与浸泡前相同, 明显优于常见PVA/CS复合水凝胶体系(表S2, 见本文支持信息). ...
1
... 由于亲水性侧链以及网络通道的存在, 大部分水凝胶遇水膨胀, 极大限制了其实际应用[1 ,8 ,37 ] . 因此, 借鉴文献[11 ]方法评价了其抗溶胀特性. 由图8 (A)可见, 室温下PVA-CS和PVA-CS-6.16-30两种水凝胶在去离子水中浸泡12 h后, 溶胀度分别为67%和0. 同时, PVA-CS水凝胶的直径由10 mm增加至13 mm, 而PVA-CS-6.16-30的直径几乎不变[图8 (B)]. 由图8 (C)和(D)可见, PVA-CS在去离子水中溶胀平衡后其抗拉强度和断裂伸长率分别衰减至0.05 MPa和90%, 与文献报道值接近[33 ] . 而处于溶胀平衡状态的PVA-CS-6.16-30水凝胶的抗拉和抗压强度依然分别高达2.8和7.5 MPa, 远高于常见抗溶胀水凝胶在千帕范围的抗拉强度[10 ,11 ] , 也优于大多数物理交联水凝胶[38 ] . 因为传统水凝胶内部渗透压高于外部水溶液[39 ,40 ] , 而且其多孔结构有利于水分子扩散, 所以遇水后体积显著膨胀. 而PVA-CS-6.16-30水凝胶中的PVA链在形成结晶微区时处于预拉伸状态, 构象熵较低[41 ] , 而非共价键的协同交联作用进一步降低了网络缺陷[16 ] , 因此具有优异的耐溶胀性能. 将1.0 g PVA-CS-6.16-30水凝胶在100 mL去离子水中浸泡2 d后测得水溶液电导率为1.323 μS/cm, 而去离子水的电导率为1.320 μS/cm(表S1, 见本文支持信息). 根据氯化钠浓度与电导率的标准曲线(y =0.6312x +0.01)计算可知, NaCl残余量为0.012 mg/kg, 远低于205(mmol/kg成人体重)的临界安全浓度[17 ] . Yang等[26 ] 制备的PAM/CS水凝胶及Gao等[42 ] 构筑的PVA/NaCl水凝胶(NaCl含量为78.3 g/kg水凝胶)的生物相容性均已得到细胞实验证实. 考虑到CS和PVA的安全性已经得到FDA认证, 且PVA-CS-6.16-30水凝胶中NaCl含量远低于临界安全浓度, 说明该水凝胶具有较好的生物相容性. 进一步评价了PVA-CS-6.16-30水凝胶在生理环境中的耐溶胀性. 将圆柱形水凝胶在37 ℃的PBS(pH=7.4, c =0.01 mol/L)中浸泡7 d后观察其形状并评价机械性能. 由图9 和图10 可见, 浸泡7 d后该水凝胶初始形状保持不变, 且浸泡过程中样品的抗拉和抗压强度几乎与浸泡前相同, 明显优于常见PVA/CS复合水凝胶体系(表S2, 见本文支持信息). ...