联系人简介: 潘学峰, 男, 博士, 教授, 博士生导师, 主要从事生物化学、 分子遗传学及分子诊断方面的研究.E-mail: xuefengpancam@aliyun.com;丁 良, 女, 博士, 教授, 主要从事分析化学方面的研究. E-mail: 345823685@qq.com
利用涡旋混匀及室温孵育的方法制备了不同形貌的鱼精蛋白-siRNA复合体, 并利用聚丙烯酰胺凝胶电泳结合银染、 原子力显微镜和透射电子显微镜等手段进行了结构表征. 结果表明, 鱼精蛋白可以和不同的siRNA分子以不同的质量比形成球形和纤维状鱼精蛋白-siRNA复合物. 在此基础上, 利用Mg2+等金属离子探针, 确认鱼精蛋白与siRNA的磷酸-戊糖骨架之间通过静电力发生作用. 利用原子力和透射电子显微镜表征了鱼精蛋白-siRNA复合体的形貌和结构特征; 利用激光纳米粒度仪测量了该复合体的粒径; 并进一步比较了黑色素瘤细胞对不同形貌复合体的吞噬及药效学特征.
Protamine-siRNA complexes of different morphologies were prepared by vortex mixing different mass ratios of protamine and siRNA at room temperature, which could be resolved by polyacrylamide gel electrophoresis with silver staining. The protamine-siRNA complexes were observed under atomic force and transmission electron microscopy, respectively. It was found that similarly shaped protamine-siRNA complexes could be formed by protamine with different siRNA molecules, indicated that the interaction between protamine and siRNA was independent on the base composition of siRNA. Moreover, the interactions between the protamine and the siRNA molecules were characterized by ionic probes, including Mg2+ etc. And the morphologies, the particle sizes as well as the structural properties of the protamine-siRNA complexes were further characterized using atomic force microscope, dynamic light scattering and transmission electron microscope, respectively. The results show that protamine formed toroid complexes and fibrous composites with siRNA molecules respectively in the light of the different mass ratios between protamine and siRNA. In the meantime, the phagocytosis and the pharmacodynamics of protamine-siRNA complexes of different morphologies were compared and measured using melanoma cells.
自1998年在秀丽新小杆线虫中发现RNA干扰(RNAi)现象以来, RNAi技术已经得到了普遍应用[1, 2]. RNAi技术的工作机制之一是籍细胞内源性Dicer酶加工双链RNA前体产生小干扰RNA(siRNA), 之后与AGO蛋白结合形成siRNA-沉默复合体(RISC), 致使靶mRNA特异性降解, 从而实现靶基因沉默[3, 4]. 在实际应用中, siRNA既可由细胞产生, 又可以由外部供给. 比如, 可以供给靶细胞人工合成的长双链RNA, 这些长双链RNA进入细胞后被Dicer酶识别并加工为具有效能的siRNA.
在人为递送外源性siRNA过程中, 发现体外递送的siRNA普遍存在稳定性差及与靶细胞识别的特异性问题[5]. 为此, 研究者们尝试利用天然物质与siRNA形成复合体以提高siRNA的稳定性. 其中, 鱼精蛋白得到了较多的尝试[6, 7]. 鱼精蛋白是一类富含精氨酸残基的阳离子多肽, 能与DNA的磷酸-戊糖骨架结合, 形成“ 环状” (Toroid)鱼精蛋白-DNA复合体. 哺乳类鱼精蛋白P1氨基末端含有半胱氨酸残基, 可在上述过程中形成二硫键; 而昆虫、 鸟类、 硬骨鱼、 爬行动物和大多数有袋动物的鱼精蛋白则缺乏或不含半胱氨酸残基, 因此, 与DNA结合时不具有形成二硫键的能力[8, 9]. 迄今, 鱼精蛋白的临床安全性已经得到确认, 不仅抗原性弱, 而且具有优良的生物相容性[10, 11]. 此外, 鱼精蛋白含有核定位信号(NLS), 可以被有效运送到细胞核中, 有助于提高外源性物质进入细胞核的效率[12, 13].
酪氨酸酶[14]是黑色素合成中的关键酶[15], 黑色素的异常表达可见于一系列的生理和病理过程, 如雀斑、 黄褐斑及老年斑等色素沉着性皮肤病等. 诸多证据表明, 酪氨酸酶在人黑色素瘤细胞A375呈高表达[16].
基于此, 本文选定A375黑色素瘤细胞作为表征不同形貌鱼精蛋白-siRNA纳米复合体制剂的药效学模型. 首先根据人的酪氨酸酶设计了具有特异性的siRNA[17], 通过聚丙烯酰胺凝胶电泳与银染[18]方法观察了鱼精蛋白与siRNA形成复合体的剂量效应; 利用Mg2+等离子探针分析了鱼精蛋白与siRNA分子的作用方式[19, 20, 21]; 利用原子力显微镜和透射电子显微镜观察了鱼精蛋白-siRNA复合体的结构形貌[22, 23], 在此基础上进一步比较了不同形貌的鱼精蛋白-siRNA复合体被人黑色素瘤细胞A375胞吞及入胞后所表现出的药效差异.
siRNA-1(正义链siRNA:5'-AAUCCUAACUUACUCAGCCCAGCAUCA-3',反义链siRNA:3'dTdT-UUAGGAUUGAAUGAGUCGGGUCGUAGU-5'),siRNA-2(正义链siRNA:5'-AAUUGUAACCUAAUACAAAGUGUAGCC-3',反义链siRNA:3'-dTdT-UUAACAUUGGAUUAUGUUUCACAUCGG-5')和lipoHigh脂质体购于生工生物工程(上海)股份有限公司; 3-(4, 5-二甲基噻唑-2)-2, 5-二苯基四氮唑溴盐(MTT)和鱼精蛋白(Protamine from salmon, 分析纯)购于美国Sigma公司; 氢氧化钠(分析纯)购于天津市科密欧化学试剂有限公司; 过硫酸铵、 甲醛、 冰乙酸、 硝酸银和乙二胺四乙酸二钠(分析纯)购于天津市大茂化学试剂厂; 溴酚蓝(分析纯)购于天津市光复科技发展有限公司; 蔗糖(分析纯)购于天津市北方天医化学试剂厂; 6× 上样缓冲液(含质量分数0.25%的溴酚蓝、 质量分数40%的蔗糖及体积分数3%, pH=8.0, 0.5 mol/L的Na2EDTA· 2H2O溶液); 4-羟乙基哌嗪乙磺酸(HEPES, 分析纯)购于南京旋光科技有限公司; 氯化钠和氯化钾(分析纯)购于国药集团化学试剂有限公司; 氯化锰、 氯化钙和氯化镁(分析纯)购于天津光复科技发展有限公司; 四甲基乙二胺(TEMED, 分析纯)购于天津市光复精细化工研究所; 质量分数30%的丙烯酰胺(聚丙烯酰胺与N, N'-亚甲双丙烯酰胺质量比为29∶ 1)和β -巯基乙醇(分析纯)购于北京博奥拓达科技有限公司; 10× Tris-硼酸缓冲液(TBE)和二甲基亚砜(DMSO, 分析纯)购于北京索莱宝科技有限公司; 3-氨丙基三乙氧基硅烷(APTES, 分析纯)购于上海邦成化工有限公司.
DW-86L388J型超低温冰箱(青岛海尔股份有限公司); SW-CJ-2FD型超级工作台(苏州安泰空气技术有限公司); BG-gdsAUTO520型凝胶成像分析系统、 BG-ver MINI型垂直电泳槽和BG-power600h型电泳仪电源(北京百晶生物技术有限公司); IS-RDV1型摇床(美国精骐有限公司); 摩尔基因型1810S超纯水机(重庆摩尔水处理设备有限公司); Tecnai G2 F20 S-TWIN型透射电子显微镜(TEM, 美国FEI公司); Agilent 5500 AFM-SPM型原子力-扫描探针显微镜(AFM, 美国Agilent公司); Delsa Nano C 纳米粒度仪(美国Beckman Coulter 公司); 311型CO2恒温细胞培养箱(美国Thermo Scientific公司); FV1000型激光共聚焦显微镜(日本Olympus公司); EL× 800型全自动酶标仪(美国BioTek公司).
1.2.1 鱼精蛋白-siRNA复合体的制备 取5.0 μ L用20 mmol/L HEPES缓冲液(pH=7.4)稀释的不同浓度的鱼精蛋白液, 逐滴加入到5.0 μ L 8.6675 μ g/mL siRNA-1溶液中[24] , 在保持鱼精蛋白与siRNA-1的质量比分别为15∶ 1, 20∶ 1, 25∶ 1, 30∶ 1, 35∶ 1和40∶ 1的前提下, 用HEPES缓冲液定容至50.0 μ L, 涡旋混匀5 min, 室温下孵育30 min, 使之形成鱼精蛋白-siRNA-1复合体. 按照上述过程制备质量比分别为15∶ 1, 20∶ 1, 25∶ 1, 30∶ 1, 35∶ 1和40∶ 1的鱼精蛋白-siRNA-2复合体. 对制备的鱼精蛋白-siRNA复合体用质量分数20%的聚丙烯酰胺凝胶电泳解析分子量大小.
实验中, 质量比为20∶ 1的鱼精蛋白-siRNA-1复合体的制备基本步骤同上. 具体组方按表1进行, 在保持反应体系总体积不变的前提下, 依次增加鱼精蛋白和siRNA-1的体积.
| Table 1 Preparation of protamine-siRNA-1 complex with a mass ratio of 20∶ 1 |
1.2.2 聚丙烯酰胺凝胶电泳及银染 聚丙烯酰胺凝胶电泳的凝胶制备、 电泳、 银染及成像参照文献[18, 25]方法.
1.2.3 鱼精蛋白与siRNA的作用方式探究 向质量比为20∶ 1的鱼精蛋白-siRNA-1复合体混合液中分别加入NaCl, KCl, CaCl2, MnCl2和MgCl2, 使每种盐的最终浓度分别为0, 2.5, 5, 10, 15, 25和50 mmol/L, 进行聚丙烯酰胺凝胶电泳(PAGE)及银染成像. 向质量比20∶ 1鱼精蛋白-siRNA-1复合体混合液中加入MgCl2使Mg2+浓度分别为0, 2.5, 5, 10, 15, 25和50 mmol/L, 涡旋混匀5 min, 室温下孵育30 min后, 进行聚丙烯酰胺凝胶电泳并银染成像.
1.2.4 鱼精蛋白-siRNA复合体的结构表征 取约10 μ L质量比20∶ 1和40∶ 1的鱼精蛋白-siRNA-1复合体样品滴在铜网上, 真空冷冻干燥约30 min, 用5 μ L含质量分数 2%的磷钨酸进行染色(染色时间约3 min), 从铜网侧边吸走多余染色液, 经真空冷冻干燥后, 用TEM进行观察.
参照文献[26]方法制备AFM样品, 用原子力-扫描探针显微镜进行观察.
1.2.5 鱼精蛋白-siRNA复合体粒度的测定 利用激光纳米粒度仪测定质量比为15∶ 1, 20∶ 1, 25∶ 1, 30∶ 1, 35∶ 1和40∶ 1的鱼精蛋白-siRNA-1复合体的粒径大小, 将样品适当稀释, 过滤, 置于比色皿中测试, 每个样品平行测定3次.
1.2.6 鱼精蛋白-siRNA复合体对A375细胞增殖的影响 按照1.2.1节步骤制备鱼精蛋白-siRNA-1复合体(siRNA1用cy3荧光标记, 浓度为0.347 μ g/μ L), 根据两者质量比不同得到球状和纤维状复合体, 分别加入黑色素瘤细胞A375的培养液, 置于细胞培养箱中8 h后, 在激光共聚焦显微镜下(波长为550 nm)观察细胞.
取对数生长期的黑色素瘤细胞A375, 按5000 Cell/孔接种于96孔培养板内. 根据lipo脂质体转染实验所需siRNA浓度, 实验组每孔加入不同形貌复合体(siRNA为5 pmol), 分为lipoHigh脂质体组(培养液加入lipoHigh脂质体)、 siRNA组(培养液加入lipoHigh脂质体和siRNA1)、 磷脂微囊组(培养液加入磷脂微囊)、 球状复合体组(培养液加入磷脂微囊和球状复合体)、 纤维状复合体组(培养液加入磷脂微囊和纤维状复合体)及空白对照组. 分别转染8 h后更换培养液, 于24和48 h终止培养, 每孔加入5 mg/mL MTT溶液20 μ L, 继续培养4 h, 弃去孔中培养液, 每孔加入150 μ L DMSO, 振荡10 min, 用酶标仪检测各孔光密度(OD)值, 检测波长为490 nm. 根据下式计算细胞增殖率(RGR, %):
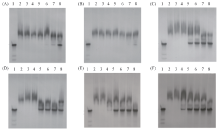
首先, 将鱼精蛋白与含有不同碱基序列的siRNA-1和siRNA-2分别以质量比为15∶ 1, 20∶ 1, 25∶ 1, 30∶ 1, 35∶ 1和40∶ 1混合, 并于室温下孵育, 形成的鱼精蛋白-siRNA复合体分别用20%聚丙烯酰胺凝胶电泳解析和银染呈带, 结果如图1(A)和(B)所示. 可见, 随着鱼精蛋白/siRNA质量比的增加, siRNA的条带逐渐变浅. 当鱼精蛋白与siRNA-1或siRNA-2的质量比为20∶ 1时, siRNA条带近乎完全消失, 表明siRNA已经与鱼精蛋白作用完全, 并形成了分子质量非均一的鱼精蛋白-siRNA复合体. 当鱼精蛋白和siRNA-1以20∶ 1的质量比同时增加反应体系中各自分子个数时, 所得鱼精蛋白-siRNA-1复合体的数量增多, 且分子量均增大[图1(C)], 表明较高分子量的鱼精蛋白-siRNA-1复合体形成与反应体系中鱼精蛋白分子和siRNA-1分子的数量呈正相关.
鉴于siRNA-1和siRNA-2之间并无碱基序列相似性, 因此鱼精蛋白与siRNA分子的结合不表现序列特异性. 基于此, 后续实验选取siRNA-1与鱼精蛋白形成的复合体, 对两者之间的作用方式、 结合位点以及复合体形态进行了研究.
研究表明, Na+, K+, Ca2+, Mn2+和Mg2+等阳离子均参与RNA的折叠[27]. 其中, Na+和K+能通过长程静电力与RNA分子中磷酸-戊糖骨架上的磷酸基作用, Ca2+, Mn2+和Mg2+既可与RNA分子发生长程静电作用, 又可以通过电荷转移和极化等非静电作用方式与RNA在短距离内发生强烈相互作用, 形成稳定复合体. 以Mg2+与DNA作用为例, Mg2+能与DNA分子中磷酸-戊糖骨架上的磷酸基形成“ 十元环” 结构[27]. 为了获悉鱼精蛋白与siRNA形成复合体所依赖的作用方式和相互作用位点, 分别利用Na+, K+, Ca2+, Mn2+和Mg2+等阳离子作为探针, 采取与鱼精蛋白-siRNA复合体共混等方式, 分析了这些离子与鱼精蛋白竞争siRNA的能力.
随着加入的金属阳离子浓度的增加, 鱼精蛋白-siRNA复合体中的鱼精蛋白被阳离子逐渐替换, 形成siRNA-阳离子复合物. 图2(A)和(B)表明, 较低浓度的Na+和K+基本不影响复合体的稳定性; 但当Na+和K+浓度分别为15和25 mmol/L时, 开始出现游离siRNA[图2(A)lane 6和图2(B)lane 7]. 此结果表明, Na+与siRNA结合的能力大于K+与siRNA的结合力. 一价金属阳离子与相同类型siRNA结合的差异, 表明二者的结合并不只依赖简单的静电长程作用. 进一步比较了二价金属阳离子Ca2+和Mn2+(离子半径Ca2+> Mn2+)对鱼精蛋白-siRNA复合体中鱼精蛋白的竞争能力. 图2(C)和(D)表明, Ca2+和Mn2+均对鱼精蛋白-siRNA复合体中鱼精蛋白和siRNA的相互作用产生影响, 表现为 Ca2+< Mn2+. 与一价金属阳离子Na+和K+相比, Ca2+和Mn2+在浓度为10 mmol/L时开始与鱼精蛋白发生明显的作用, 当体系中Ca2+和Mn2+浓度为10~15 mmol/L时, 2种阳离子各自与鱼精蛋白的竞争作用差别不明显, 但均表现为Ca2+< Mn2+. 当反应体系中Ca2+的浓度增加至25和50 mmol/L时, 鱼精蛋白-siRNA复合体的分子量进一步降低[图2(C) lanes 7和8]; 在同等条件下, Mn2+却不再对鱼精蛋白-siRNA复合体的分子量产生明显影响[图2(D) lanes 7和8]. 上述结果表明, 二价阳离子Ca2+和Mn2+对鱼精蛋白与siRNA之间相互作用也不仅是通过静电力实现的.
为了进一步理解Ca2+和Mn2+作用的差异, 考察了Mg2+对鱼精蛋白-siRNA复合体稳定性的影响. Mg2+离子半径小、 电荷密度高, 可与DNA分子中磷酸-戊糖骨架上的磷酸基团形成“ 十元环” 结构(Mg2+-DNA复合体)[27]. 鉴于RNA和DNA拥有相似的磷酸-戊糖骨架, 且磷酸基团在DNA和RNA磷酸-戊糖骨架中的理化性质相同, 考察了Mg2+对鱼精蛋白-siRNA复合体稳定性的影响.
由图2(E)可知, 当反应体系中含有5 mmol/L Mg2+时, 鱼精蛋白与siRNA(质量比20∶ 1)形成复合体的反应明显受到Mg2+的影响, 出现了Mg2+-siRNA复合体和较低分子量的鱼精蛋白-siRNA复合体[图2(E)lane 4]. 随着反应体系中Mg2+浓度的增加, 出现了大量的Mg2+-siRNA复合体[图2(E)lanes 5~8], 表明Mg2+能抑制鱼精蛋白与siRNA的结合. 为了进一步确定Mg2+抑制鱼精蛋白与siRNA结合的反应类型, 尝试向鱼精蛋白-siRNA复合体中加入不同浓度的Mg2+[图2(F)]. 结果表明, 5 mmol/L的Mg2+可以“ 夺取” 鱼精蛋白-siRNA复合体中的siRNA, 形成Mg2+-siRNA复合物[图2(F) lane 4]; 当体系中Mg2+浓度小于25 mmol/L时, 鱼精蛋白-siRNA复合体和Mg2+-siRNA复合体分布基本达到平衡[图2(F) lanes 5~7]; 但继续增大Mg2+浓度至50 mmol/L时, 终产物以Mg2+-siRNA复合体为主[图2(F) lane 8]. 这表明Mg2+、 鱼精蛋白与siRNA的作用体现浓度依赖竞争. 对比图2可见, 二价阳离子Mg2+, Mn2+和Ca2+与鱼精蛋白-siRNA复合体中的鱼精蛋白“ 争夺” siRNA的能力依次减弱. 基于Mg2+与DNA分子可形成稳定“ 十元环” 结构, 推测Mn2+, Ca2+若与 siRNA形成类似Mg2+-siRNA的“ 十元环” 结构, 其能力均弱于Mg2+.
TEM结果(图3)表明, 当鱼精蛋白与siRNA质量比分别为20∶ 1和40∶ 1时, 形成了不同形貌(球形和纤维形)的复合体.
 | Fig.3 TEM images of protamine-siRNA complexes formed by protamine and siRNA with the mass ratios of 20∶ 1(A) and 40∶ 1(B) |
AFM结果(图4)表明, 鱼精蛋白与siRNA形成的“ 颗粒状” 复合体为鱼精蛋白通过静电作用将siRNA分子压缩形成的环状结构[8]. 鲑鱼精蛋白具有保守的精氨酸结构域, 在HEPES缓冲液中精氨酸解离带正电荷, siRNA磷酸骨架上的磷酸基团则带有负电荷, 两者通过静电力把siRNA单体“ 压缩” 成环[图4(A)]. 此外, 当鱼精蛋白与siRNA的质量比进一步增加, 则形成纤维状复合体[图4(B)和(C)]. 不同形态的鱼精蛋白-siRNA复合物中鱼精蛋白与siRNA相互作用的示意图见Scheme 1.
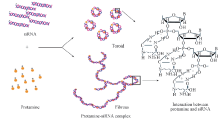 | Scheme 1 Schematic illustrations for the interactions between protamine and siRNA in protamine-siRNA complexes of different morphologies |
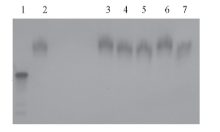
有些鱼精蛋白中含半胱氨酸残基, 易形成二硫键, 本文使用的鲑鱼精蛋白在理论上不含半胱氨酸. 但是, 为了进一步确认所得鱼精蛋白-siRNA纤维复合体不是通过鱼精蛋白形成二硫键而形成, 对纤维状复合体中是否含有二硫键进行了分析. 分别用0, 5, 10, 15, 20和40 mmol/L的β -巯基乙醇对复合体进行还原处理. 电泳结果如图5所示, 可见纤维状鱼精蛋白-siRNA复合体不因巯基乙醇的处理而发生电泳行为的改变.
利用纳米粒度仪测试了制备的不同鱼精蛋白-siRNA复合体的粒径, 结果列于表2. 可见, 随着反应体系中鱼精蛋白量的增加, 形成的复合体的粒径也增大, 表明鱼精蛋白与siRNA可依据反应体系中二者分子量不同形成不同类型的复合体.
| Table 2 Particle sizes of the protamine-siRNA complexes |
由激光共聚焦显微照片(图6)可见, 颗粒状和纤维状鱼精蛋白-siRNA复合体均能进入黑色素瘤细胞A375内, 且主要分布于细胞质中. 随机选取不同视野进行观察并计算转染效率(荧光细胞数占总细胞数的比例). 经计算得出球状鱼精蛋白-siRNA复合体转染效率约为69%, 纤维状鱼精蛋白-siRNA复合体转染效率约为72%, 后者略高于前者.
 | Fig.6 Phagocytosis of A375 melanoma cells on toroid(A) and fibrous(B) protamine-siRNA complexes under confocal fluorescence microscopy |
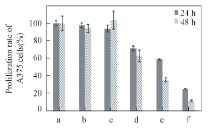
通过MTT实验评价了2种形貌的鱼精蛋白-siRNA复合体对黑色素瘤细胞A375增殖的影响, 结果表明, siRNA组、 球状复合体组和纤维状复合体组对黑色素瘤细胞A375的增殖均有明显影响, 且随着细胞培养时间的延长, 细胞增殖率降低, 存在显著性差异(见图7). 结果表明, 将2种形貌的鱼精蛋白-siRNA复合体递送入细胞的效率与之后所表现出的药效学作用与Lipo脂质体递送siRNA的效果相当, 而且纤维状鱼精蛋白-siRNA复合体对黑色素瘤细胞A375的增殖抑制效果较球状鱼精蛋白-siRNA复合体更好.
鱼精蛋白和siRNA之间相互作用可分别形成螺旋环(Toroid)颗粒状和纤维状鱼精蛋白-siRNA复合体. 其中, 发生在鱼精蛋白碱性氨基酸侧基和siRNA磷酸-戊糖骨架之间的静电作用是鱼精蛋白和siRNA相互作用的主要作用方式. 不论是形成颗粒状鱼精蛋白-siRNA复合体, 还是形成纤维状鱼精蛋白-siRNA复合体均不依赖siRNA碱基排列顺序. siRNA与鱼精蛋白形成复合体有助于siRNA向黑色素瘤A375细胞递送, 而颗粒状复合体与纤维状复合体在细胞递送效率上并未见显著性差异. 但在入胞后所能发挥的药效学效果上具有明显差异, 表现为纤维状鱼精蛋白-siRNA复合体比颗粒状鱼精蛋白-siRNA复合体具有更高的抑制人黑色素瘤A375增殖能力. 不同形貌的鱼精蛋白-siRNA复合体在药物递送环节中的差异尚需深入研究.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|