联系人简介: 刘洪梅, 女, 博士, 教授, 主要从事低维材料电子输运研究. E-mail: liuhongmei@lyu.edu.cn
利用密度泛函理论研究了气体分子(NH3, H2O, H2S, NO2)吸附在二维M3(HIB)2(M=Ni, Cu; HIB为六亚氨基苯)薄膜上体系的几何结构和电子结构的变化. 结果表明, 2种薄膜对气体分子的响应不同. 其中NH3, H2O和H2S在M3(HIB)2薄膜表面的吸附较弱, 主要与薄膜的亚氨基形成氢键, 吸附能均小于-0.36 eV, 吸附对体系电子性质的影响很小. 但是 NO2分子在薄膜表面形成化学吸附, 吸附能在-0.65~-1.72 eV范围内. 吸附NO2分子使其电子结构发生明显改变, 如Cu3(HIB)2在费米能级处打开带隙, 由金属性质转变为半导体性质. 这是由于NO2分子的 pz轨道与金属原子$d_{z}^{2}$ 轨道发生了强烈的轨道杂化. 此外, 研究发现高浓度的NO2分子吸附能够使Ni3(HIB)2薄膜由非磁性变为磁性体系, 由普通金属性质变为半金属性质; 而高浓度的NO2分子使Cu3(HIB)2薄膜由金属性质变为半导体性质, 薄膜电导率降低.
The effects of gas molecules(NH3, H2O, H2S, and NO2) adsorption on two-dimensional M3(HIB)2(M=Ni, Cu; HIB=hexaiminobenzene) surfaces on the geometric structure and electronic structure were studied via the first-principles theory. The results show that there are different responses of two thin films to four gas molecules. The adsorptions of NH3, H2O and H2S on the surface of M3(HIB)2 thin films are weak and the gas molecules tend to form hydrogen bond with the imino group of the film with an adsorption energy that is less than -0.36 eV. These weak adsorptions just slightly affect the electronic properties of the adsorbed films. In contrast, NO2 molecules are strongly chemisorbed on the two films with adsorption energy in the region of -0.65—-1.72 eV. The adsorption of NO2 molecules evidently changes the electronic structures of the film. For instance, there is a band gap opening at the Fermi level for Cu3(HIB)2 film and it changes from metal to semiconductor. This feature originates from the strong orbital hybridization between NO2 pz and metal $d_{z}^{2}$ orbitals. Furthermore, when NO2 molecules with a high concentration are adsorbed on M3(HIB)2 surface, the Ni3(HIB)2 film transits from nonmagnetic to magnetic states and changes from metallic to half-metallic property, while the Cu3(HIB)2 film converts to semiconductor, suggesting a potential application of M3(HIB)2 films in gas sensing.
近年来, 利用金属有机框架(MOFs)材料作为电子和光电子器件的新一代功能材料已经引起了广泛关注[1~3]. MOFs材料是一类由无机金属离子或团簇和有机配体组成的配位化合物. 目前, 已实验合成了大量的金属有机框架材料, 这些材料兼有无机材料的刚性和有机材料的柔性, 由于其较高的表面积、 高孔隙率、 良好的化学可调性以及独特的光学和电学性质, 在能源和功能电子器件方面发挥了重要的作用, 在气体储存[4, 5]、 分离[6, 7, 8]、 催化[9, 10, 11, 12]及传感[13]等方面具有广泛的应用.
二维MOFs材料因为体相中层与层之间的弱相互作用为范德华力, 可以通过从下至上的化学方法合成, 或通过简单的剥离法制备. Nishihara等[14, 15]利用化学合成法制备了一类二维六角晶格结构的MOFs, 即镍离子与六巯基苯形成的配合物(Ni3C12S12), 其单层的薄膜呈现半导体性质. 此后, 发展了多种实验方法制备二维MOFs, 通过替换Fe(Ⅱ )[16], Co(Ⅱ )[9], Pd(Ⅱ )[17], Pt(Ⅱ )[18], Cu(Ⅱ )[19]等过渡金属离子, 或利用巯基、 氨基、 酚羟基等为络合基团的多种有机配体[20], 实现对二维MOFs孔径及电学性质的调控, 得到电荷迁移率较高的薄膜. 近期制备成功的二维M3(HIB)2(M=Ni, Cu; HIB=六亚氨基苯)薄膜[21, 22]实验证明具有良好的导电性, 在气体传感方面可具有潜在应用.
实验发现有机小分子的吸附导致基于Ni或Cu离子的二维MOFs材料的导电性发生显著变化, 对于不同的有机分子, 电导的响应不同[20]. 甲醇和乙醇能提高Ni3(HITP)2(HITP=2, 3, 6, 7, 10, 11-hexaiminotriphenylene)薄膜的电导率, 但是降低Cu3(HITP)2薄膜的电导率; Ni3(HITP)2对胺类和醚类分子无响应, Cu3(HITP)2在胺类和醚类分子的氛围中电导率有显著降低[23]. 2种薄膜的结构相似, Cu, Ni产生不同的响应以及吸附作用的本质还不明确. Smith等[24]在聚合物薄膜上制备了Ni3(HHTP)2和Cu3(HHTP)2(HHTP=2, 3, 5, 6, 10, 11-hexahydroxytriphenylene)的气体传感阵列, 利用石墨电极测量薄膜的导电性质, 发现2种阵列传感器可区分H2O, NH3, NO和H2S气体. 而基于稀土元素的MOFs结构对H2S和NO2表现出较高的灵敏度和良好的选择性[25], 对H2S的检测下限可以达到5.4 ng/mL. Sarkar等[26]发现铁磁性的Co3C12S12吸附CO后磁性及电导率均有显著变化, 有可能应用于气体传感器. Liu等[27, 28]发现吸附气体分子能够调控二维Ni3C12S12薄膜电学性质, 化学吸附的CO和NO 使单层薄膜由半导体性质变为金属性质, 电导率明显增加, 而物理吸附的O2对体系性质基本没有影响.
研究发现, M3(HIB)2具有良好的电导率, 在300 K时其体相电导率约为1000 S/m[21], 远高于同类其它二维MOFs的电导率, 而且M3(HIB)2具有多孔结构, 以及金属离子具有未填满的d轨道, 薄膜容易吸附气体分子, 可能影响体系的电子结构和导电性质. 因此, M3(HIB)2应用于气体传感时能够得到较高的电导信号, 有利于实现较低的检测限. 本文利用第一性原理方法研究了二维M3(HIB)2(M=Ni, Cu)薄膜对不同气体分子的吸附响应. 研究了薄膜表面吸附NH3, H2O, H2S和NO2等分子后体系几何结构和电子结构的变化, 探索了其在气体传感方面的潜在应用. 结果表明, NH3, H2O和H2S 3种分子在2种薄膜表面的吸附都比较弱, 对体系电子结构性质的影响较小. 而NO2分子在薄膜表面的吸附作用很强, 使体系电子结构发生明显变化.
利用从头算软件包(VASP)[29]进行第一性原理计算, 采用投影缀加波方法准确有效地计算材料的电子性质. 交换相关泛函采用广义梯度近似(GGA)的Perdew-Burke-Ernzerhof(PBE)方法[30]. 利用Grimme方法(D3)[31]校正吸附体系内的范德华相互作用. 计算采用的平面波截断能为500 eV, k点网格为7× 7× 1. 计算电子态密度时, 采用了更为密集的k点网格(19× 19× 1). 为了防止相邻层间的相互作用, 设置了1.5 nm的真空层. 结构弛豫过程中能量收敛标准为10-5 eV, 每个原子受力小于0.2 eV/nm. 计算孤立气体分子的结构和能量时, 采用的原胞是边长为1.5 nm的立方体, k点网格为1× 1× 1.
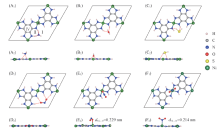
图1(A)给出了二维M3(HIB)2(M=Ni, Cu)薄膜的周期性结构, 可见2种材料都具有kagome晶格. 每个原胞共有39个原子, 包含3个金属原子、 12个C原子、 12个N原子和12个H原子. 优化后的晶格常数分别为1.338 nm(Ni)和1.366 nm(Cu), 与文献[21, 32]结果(1.35 nm)相吻合. Ni3(HIB)2薄膜是平面结构, 如图1(B)所示, Ni原子与4个N原子形成平面正方形的配位结构; 而Cu3(HIB)2薄膜具有褶皱, 为非平面结构, 如图1(C)所示. 这是由于Ni原子采用dsp2杂化方式与4个N原子配位, 形成良好的平面π 共轭; 而Cu原子采用sp3杂化方式与N成键, 4个N原子分别位于Cu的上下两侧. 金属原子与N原子的键长分别为0.184 nm(Ni— N)和0.198 nm(Cu— N).
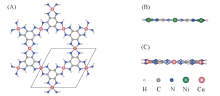 | Fig.1 Lattice structure(A) of 2D M3(HIB)2 films(M=Ni, Cu) and the side views of Ni3(HIB)2 (B) and Cu3(HIB)2(C) |
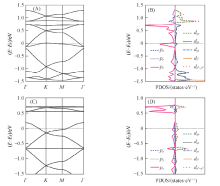
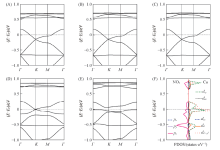
图2给出了M3(HIB)2薄膜的能带结构和电子态密度. Ni3(HIB)2 薄膜为非磁性体系, 这是由于Ni采取dsp2杂化与周围的4个N形成配位键, 属于平面正方形晶体场. 由图2(A)可见, 在-0.150.75 eV范围内, Ni3(HIB)2有4条能带, 包括穿过费米面(EF)的Dirac带, Dirac点位于0.50 eV. 在0.751.5 eV范围内有1条平带和2条Dirac带构成的kagome能带. 通过分析图2(B)中不同原子轨道的投影态密度(PDOS), 发现费米面附近能带主要来源于六亚氨基苯(HIB)中C, N原子的pz以及少量的Ni的dxz和dyz电子态, 说明Ni的dxz, dyz电子与HIB的pz电子在平面上形成良好的共轭. 而0.751.5 eV 范围内的kagome能带主要来源于Ni的dxy,
首先研究了NH3, H2O, H2S和NO2分子的吸附对Ni3(HIB)2薄膜几何结构和电子结构性质的影响. 图3给出了二维Ni3(HIB)2薄膜吸附不同分子的几何结构, 形成的氢键用虚线表示. 每个原胞吸附一个分子, 考虑了4个可能的初始吸附位置, 分别是吸附分子位于薄膜孔洞上方并靠近亚氨基(Ⅰ , Ⅱ )、 吸附分子位于金属原子上方(Ⅲ )以及吸附分子位于苯环上方(Ⅳ ), 如图3(A)所示. 经过结构优化, 吸附4种分子能量最低的位置均为Ⅰ 或Ⅱ , 即吸附分子靠近亚氨基, 形成X…H— N类型的氢键, 图3(A1)~(D1)和(A2)~(D2)给出了详细的吸附结构.
表1列出了二维Ni3(HIB)2薄膜吸附不同分子后薄膜中的H与吸附分子的最近距离(dH— X), 其中H表示薄膜亚氨基中的氢原子, X表示气体分子的原子, 分别对应N(NH3), O(H2O)和O(NO2)原子. 对于几种分子的吸附, dH— X的大小顺序为0.179 nm(NO2)< 0.229 nm(H2O)< 0.247 nm(NH3), 说明NO2分子与亚氨基的相互作用最强, H2O和NH3与亚氨基形成的氢键稍弱. H2S分子与之不同, H2S与亚氨基中的H形成的氢键 S…H— N键长(0.294 nm)大于H2S与亚氨基中的N形成的氢键S— H…N键长(0.259 nm), S— H…N氢键如图3(C1, C2)中的红色虚线所示. 对比其它3种分子, H2S分子形成的氢键最弱. NO2吸附在亚氨基附近(Ⅰ 位)的结构如图3(D1, D2)所示, NO2与薄膜在同一平面内, 其中一个O原子同时靠近薄膜2个亚氨基中的H原子, 最近的距离是0.179 nm, 形成O…H— N类型的氢键. 另外, NO2与其它3种气体分子的吸附不同, NO2分子不但与薄膜的H相互作用, 还可以通过O或N与Ni离子形成配位键, 图3(E1, E2) 和(F1, F2)给出了2种Ⅲ 吸附构型, 2种结构中Ni— O与Ni— N的距离分别为0.229和0.214 nm.
| Table 1 Distance dH— X between the hydrogen atom and the adsorbed atoms X(X=N for NH3, O for H2O, O for NO2)* |
为了进一步理解气体分子在薄膜表面的吸附作用, 计算了吸附能Eads, 计算式如下:
式中: E(MOF-gas)(eV), E(MOF)(eV)和E(gas)(eV)分别为吸附分子的M3(HIB)2薄膜、 纯净的
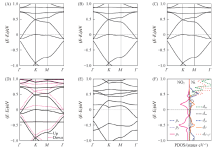
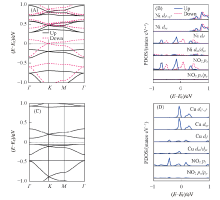
图4给出了二维Ni3(HIB)2薄膜吸附4种分子的能带结构. 与纯净Ni3(HIB)2薄膜的能带结构相对比, 吸附NH3, H2O和H2S分子之后, 位于0.5 eV的Dirac点分别打开了0.005~0.01 eV的小带隙, 这是由于吸附分子破坏了体系的对称性, 3种分子使亚氨基中的N— H键拉长了0.0001~0.0002 nm. 费米面附近能带几乎无变化[图4(A)~(C)], 可以预测吸附对薄膜的导电性质基本无影响. 这是由于3种分子距离薄膜表面较远, 相互作用非常弱. 实验测量了NH3分子对Ni3(HITP)2和Ni3(HHTP)2薄膜导电性的影响, 发现NH3分子对其导电性没有影响[20, 24], 本文结果与实验结论一致. NO2分子吸附在Ⅰ 或Ⅲ 位置后[图4(D)和(E)], 体系仍然为金属性质, 但是能带结构变化较大. 顺磁性NO2分子的吸附诱导薄膜产生磁性. NO2分子采用Ⅰ 吸附构型时体系磁矩为1 μ B, 磁性体系比非磁性的能量低8 meV, 但是Ⅲ Ni— O和Ⅲ Ni— N吸附构型, 非磁性体系的能量最低. 对于Ⅰ 吸附构型, 由图4(D)可见, 在-0.4 eV处出现一条平带, 主要来源于吸附的NO2分子. 对于Ⅲ Ni— O吸附构型, 由于吸附分子后体系几何结构的对称性被破坏, 图4(E)的kagome能带变形. 另外, NO2分子与Ni原子之间的电荷转移导致费米面发生移动, 而O原子与Ni原子之间强烈的轨道杂化产生了更多的电子态. 对比NO2分子的Ⅰ 和Ⅲ 吸附构型, 虽然Ⅰ 吸附构型中NO2分子与薄膜的氨基之间有强相互作用, 但从图3(D)的侧视图可以看出薄膜仍保持平面构型. 而Ⅲ Ni— O吸附构型中, 吸附的NO2分子使Ni突出薄膜平面约0.013 nm, 平面构型发生扭曲. 另一方面, 而Ni3(HIB)2薄膜中Ni的d电子态对费米能级附近的能带有贡献[图2(B)], Ⅲ Ni— O吸附构型中Ni与O原子产生强烈的轨道杂化, 但是在Ⅰ 吸附构型中并无Ni与NO2分子的相互作用. 因此, Ⅲ 吸附构型对薄膜电子结构的影响比Ⅰ 吸附构型更明显.
从能带结构的分析可以看出, NO2分子的Ⅲ Ni— O吸附构型对薄膜电子结构的改变最显著. 为了进一步理解吸附分子与薄膜的相互作用, 图4(F)给出了Ⅲ Ni— O吸附构型的Ni原子和吸附的NO2分子的投影态密度. 对比图2(B)中纯净Ni3(HIB)2薄膜的PDOS, 发现在-1.00.5 eV范围内, 不但Ni的dxz和dyz 电子态有贡献, 而且Ni的
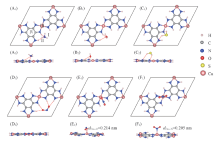
为了对比MOFs的不同金属离子对气体分子的响应, 研究了NH3, H2O, H2S和NO2分子对Cu3(HIB)2薄膜几何结构和电子结构的影响. 同样设置了4个初始位置, 如图5(A1, A2)所示. 类似在Ni3(HIB)2薄膜上的吸附, 分子靠近亚氨基的能量最低(Ⅰ 或Ⅱ 吸附位置), 形成X…H— N类型的氢键. 表2列出了二维Cu3(HIB)2薄膜吸附不同分子时亚氨基的H与吸附分子的最近距离(dH— X), X分别对应N(NH3), O(H2O)和O(NO2)原子. dH— X的大小顺序为0.183 nm(NO2)< 0.245 nm(H2O)< 0.249 nm(NH3). H2S与亚氨基中H形成的氢键 S…H— N键长(0.334 nm)大于H2S与亚氨基中N形成的氢键S— H…N键长(0.279 nm), S— H…N氢键如图5(C1, C2)中的红色虚线所示.
| Table 2 Distance dH— X between the hydrogen atom and the adsorbed atoms X(X=N for NH3, O for H2O, O for NO2)* |
与在Ni3(HIB)2表面的吸附类似, NO2分子的结合最强, 而H2S分子最弱. NO2吸附在亚氨基附近Ⅰ 位置能量最低, 如图5(D1, D2)所示, 每个O原子同时靠近两个亚氨基中的H原子, 最近的距离是0.183 nm, 形成O…H— N类型的氢键. 另外, NO2分子也可以吸附在Cu原子上方(Ⅲ 位置), 通过O或N与Cu原子结合, 图5(E1, E2)和(F1, F2)给出了Ⅲ 位置的吸附结构, Cu— O与Cu— N的距离分别为0.214 nm或0.205 nm. 4种分子在Cu3(HIB)2薄膜表面的吸附能Eads如表2所示, 其中NH3, H2O和H2S的吸附能在-0.27~-0.34 eV范围内, 吸附作用较弱, 属于物理吸附. 而NO2的Ⅰ 吸附构型Eads=-1.41 eV, 吸附在Cu原子上方的Ⅲ Cu— O和Ⅲ Cu— N构型的吸附能分别为-0.71和-0.65 eV, 都属于化学吸附. Bader电荷分析的结果表明, Cu3(HIB)2薄膜吸附NO2分子后发生了较强的电荷转移, Ⅰ 吸附构型的NO2分子从Cu3(HIB)2薄膜上得到0.806 e, 而其它3种分子的电荷变化都很小(表2).
图6给出了分子吸附的Cu3(HIB)2薄膜的能带结构. 吸附NH3, H2O及H2S分子后, 由于分子破坏了Cu3(HIB)2薄膜的对称性, 能带结构发生了微小变化. 如图6(A)中位于-0.15和0.69 eV能级处的Dirac点消失, 分别打开了一个0.01和0.03 eV的小带隙. 图6(B)和(C)中吸附H2O, H2S分子也打开了0.01 eV的带隙. 与图2(C)中纯净薄膜的能带结构相比, 体系仍具有金属性质, 能带结构总体变化较小, 吸附分子与薄膜的相互作用较弱, 说明吸附这3种气体分子对体系电子结构和导电性影响很小. 而图6(D)中Ⅰ 吸附构型的NO2体系电子结构变化较大, 不仅费米能级处出现一个0.02 eV的带隙, 而且费米面下方增加了一条能带, 主要来源于吸附的NO2分子. 图6(E)中NO2的Ⅲ Cu— O吸附构型在费米能级处打开了0.08 eV的带隙, 体系由金属性质变为半导体性质, 说明Cu3(HIB)2薄膜吸附少量NO2分子后导电性会降低.
由于NO2分子Ⅲ Cu— O吸附构型的能带结构发生了显著变化, 图6(F)给出了Ⅲ Cu— O吸附构型的投影态密度. 与图2(D)中纯净Cu3(HIB)2薄膜的PDOS对比, 可以看到纯净的薄膜中Cu原子的
以上结果表明NO2分子在M3(HIB)2薄膜上发生化学吸附, 并且使薄膜电子结构发生明显改变. 考虑到吸附浓度的影响, 进一步研究了M3(HIB)2薄膜吸附较高浓度的NO2时体系性质的变化. 由于薄膜一般附着在衬底上, 而衬底可能对吸附分子产生空间位阻, Ⅰ 吸附构型中NO2分子与薄膜同一平面, 吸附过程会受到衬底影响; 而NO2分子吸附在薄膜表面, 即金属原子上方(Ⅲ 位置)受到的空间位阻相对较小, 因此研究了高浓度NO2分子的Ⅲ M— O吸附构型. 吸附浓度提高2倍, 即每个金属原子各吸附一个NO2分子, 因此每个原胞中吸附3个NO2分子, 分布在薄膜的同侧. NO2分子覆盖度提高以后, Ni3(HIB)2薄膜转变为磁性体系, 磁性体系的能量比非磁性体系低46 meV, 磁矩为1μ B, 主要分布在吸附的NO2分子上. 金属原子上方吸附NO2后Ni由四配位变为五配位结构, 而且Ni原子偏离薄膜平面, 轨道杂化方式有所改变, 对磁矩也有一部分贡献. 而Cu3(HIB)2薄膜吸附高浓度的NO2分子后仍为非磁性.
图7(A)和(C)分别为Ni3(HIB)2和Cu3(HIB)2薄膜吸附高浓度NO2分子的能带结构. 发现当NO2分子的浓度增加以后, 薄膜电子结构变化更明显. 由于顺磁性NO2分子的吸附, 图7(A)中Ni3(HIB)2薄膜的能带发生自旋极化, 表现为半金属特性. 其中下自旋是金属性质, 但上自旋是半导体性质, 打开了0.45 eV的带隙. Ni3(HIB)2吸附NO2分子后体系变为半金属性质, 表明二维Ni3(HIB)2薄膜在自旋电子器件方面具有潜在应用. 而图7(C)中Cu3(HIB)2薄膜吸附高浓度的NO2分子后在费米面处打开了0.24 eV的带隙, 由金属性质变为半导体性质, 说明Cu3(HIB)2吸附NO2分子后体系的导电性降低, 可以作为检测NO2分子的气体传感材料. 从图7(B)和(D)可以看出, Ni或Cu原子的
利用第一性原理方法研究了NH3, H2O, H2S和NO2分子吸附在二维M3(HIB)2(M=Ni, Cu)表面上体系几何结构和电子结构的变化. 结果表明, 2种薄膜材料对4种气体分子的响应不同: NH3, H2O和H2S分子与M3(HIB)2薄膜的亚氨基形成了氢键, 吸附能在-0.27~-0.36 eV的范围内, 分子吸附对体系电子性质影响很微弱; NO2分子以化学吸附与2种薄膜相互作用, 既可以与亚氨基形成氢键, 也能够与金属离子形成配位键, 吸附能较高, 在-0.65~-1.72 eV的范围内, 而且吸附NO2分子使薄膜的电子结构发生明显改变, 尤其是吸附在Cu3(HIB)2 薄膜的Cu原子上方时体系在费米面处打开带隙, 由金属性质变为半导体性质. 这是由于NO2分子以pz轨道与金属的
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|