联系人简介: 黄在银, 男, 教授, 主要从事纳米物理化学方面的研究. E-mail: huangzaiyin@163.com
在室温下制备了立方体{100}、 四面体{111}、 菱形十二面体{110}和块体Ag3PO4微晶, 并进行了表征. 测定了其在不同温度下水溶液中的电导率, 结合强电解质溶液和溶解热力学理论, 得到了Ag3PO4微晶的溶解热力学函数. 以具有不同晶面的Ag3PO4微晶为模型, 研究了纳米材料溶解热力学函数的晶面效应和温度效应. 结果表明, 具有{110}晶面的菱形十二面体Ag3PO4的标准摩尔溶解吉布斯自由能(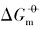 )、 标准摩尔溶解焓(
)、 标准摩尔溶解焓(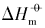 )和标准摩尔溶解熵(
)和标准摩尔溶解熵(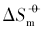 )最大, 具有{100}晶面的立方体Ag3PO4次之, 具有{111}晶面的四面体Ag3PO4最小; 溶解平衡常数(
)最大, 具有{100}晶面的立方体Ag3PO4次之, 具有{111}晶面的四面体Ag3PO4最小; 溶解平衡常数(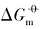 随着温度的升高而增大.
随着温度的升高而增大.
Ag3PO4 microcrystals with different facets, such as {100}(cubic), {111}(tetrahedron), {110}(rhombohedral dodecahedron), and bulk Ag3PO4 microcrystals were synthesized at room temperature. Based on the difference of the conductivity between Ag3PO4 microcrystals with different facets, the dissolution thermodynamic function of Ag3PO4 microcrystals were derived via combining the theoretical formula of strong electrolyte solution and dissolution thermodynamics. According to this method, the dissolution thermodynamic functions such as standard dissolution Gibbs free energy, standard dissolution enthalpy and standard dissolution entropy of the prepared Ag3PO4 microcrystals were gained. Moreover, the facet effect and temperature effect on these obtained dissolution thermodynamic functions were discussed. The results revealed that the dissolution thermodynamic function of rhombohedral dodecahedron Ag3PO4 were maximum, followed by cubic and tetrahedron Ag3PO4 . Along with the increase of the temperature, dissolution equilibrium constant and standard dissolution Gibbs free energy increased.
微纳米晶体因表面暴露大量原子而具有的高表面活性和特殊的物理化学性质[1]是影响其催化、 自组装、 吸附、 反应热动力学和电化学的主要原因[2].
晶面效应是微纳米晶体重要的物理化学特性之一, 不同晶面材料因表面原子结构及原子间的键合结构存在差异[3]而展现出不同的表面特性[4]. Li课题组[5, 6]实验验证了不同晶面的BiVO4光催化氧化还原的速率存在较大差异. Hardcastle等[7]计算了锐钛矿相二氧化钛的多种低指数晶面的表面能, 发现{001}晶面的表面能(0.90 J/m2)是{101}晶面(0.44 J/m2)的两倍, 意味着{001}晶面具有较高的活性. 邹伟欣[8]发现不同晶面Cu2O的稳定性、 电负性和催化性能均存在较大差异. Anton等[9]发现不同晶面的纳米硅晶对细胞具有不同的毒性作用. 陆阳[10]综述了TiO2晶面效应的研究进展, 阐述了具有不同晶面的二氧化钛材料在吸附、 光催化等方面表现出不同的特性. 可见, 微纳米晶体的晶面效应对晶体的性能有较大影响, 但目前关于晶面效应对微纳米晶体溶解热力学性质影响的研究因无法测定等原因仍存在困难[11]. 因此, 探索一种更加普适、 科学的实验原理和测定方法是表界面科学与热力学等相关交叉领域亟待解决的重要科学问题.
本文以具有{100}晶面的立方体、 具有{111}晶面的四面体、 具有{110}晶面的菱形十二面体状Ag3PO4和块体Ag3PO4微晶为例, 在本课题组前期研究[12, 13, 14, 15]的基础上, 结合同晶面和块体Ag3PO4微晶溶解热力学性质的本质差异以及强电解质溶液和溶解热力学基本理论, 采用电导率仪获取了Ag3PO4微晶的溶解平衡常数(Ksp)、 标准摩尔溶解吉而斯自由能( 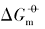
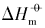
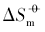
硝酸银购于天津市光复科技发展有限公司; 氯化钾、 氨水、 十二水合磷酸氢二钠、 二水合磷酸二氢钠和磷酸均购于国药集团化学试剂有限公司; 无水乙醇购于汕头西陇化工股份有限公司. 以上试剂均为分析纯.X射线粉末衍射仪(XRD, Ultima Ⅳ , 日本理学株式会社); 场发射扫描电子显微镜(FE-SEM , SUPRA 55 Sapphire, 德国卡尔蔡司公司); 电导率仪(DDS-307, 上海雷磁仪器厂).
根据文献[12]报道的湿化学法, 控制合成了块体Ag3PO4、 具有{100}晶面的立方体和具有{110}晶面的菱形十二面体Ag3PO4微晶. 参考文献[16], 利用动力学控制法合成了具有{111}晶面的四面体Ag3PO4微晶.
将电导率仪预热30 min, 待仪器稳定后用0.01 mol/L的KCl溶液测定电导率仪的电极常数, 进行电导率仪的校准. 量取50 mL蒸馏水置于50 mL锥形瓶中, 于高级恒温水槽中进行恒温, 当达到预设温度(298.15, 308.15, 318.15, 328.15, 338.15 K)后, 待电导率仪示数稳定后读取数值, 测定纯水的电导率. 使用电导率仪测定温度在298.15, 308.15, 318.15, 328.15, 338.15 K下各Ag3PO4微晶的电导率. 平行测定5次, 取平均值.
磷酸银属于难溶盐, 将溶解看作一个反应, 通过电导率来计算其溶解平衡常数[17]. 因为磷酸银在水中的溶解度非常小, 可以按照无限稀释来处理, 即
式中:
由于磷酸银为强电解质且其水溶液为极稀溶液, 当溶解反应达到平衡时, 各物质的浓度之间有以下关系:
难溶盐磷酸银的溶解反应可以认为是其完全电离生成
由此可以计算得到磷酸根离子的浓度
离子强度I(mol/kg)用如下公式表示
式中:
通过Debye-Hü ckel公式计算平均活度因子γ ± :
式中: A和B为常数; I为离子强度;
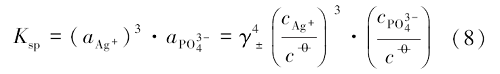
式中:$a_{{Ag}^{+}}$和$a_{{PO}^{3-}_{4}}$分别为银离子与磷酸根离子的活度; 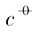
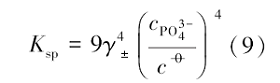
由式(9)即可求得磷酸银的溶解平衡常数
由Ag3PO4的标准溶解平衡常数 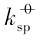
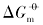
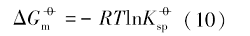
式中: R(8.314 J· mol-1· K-1)为气体常数; T(K)为反应温度.
在恒温恒压下, 当 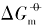
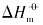
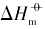
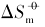
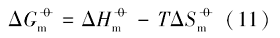
将 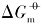
图1和图2分别为立方体、 四面体、 菱形十二面体和块体Ag3PO4微晶的SEM照片及其对应的粒径分布直方图.
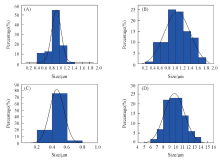 | Fig.2 Particle size distribution histogram of cube(A), tetrahedral(B), rhomb dodecahedron(C) and bulk(D) Ag3PO4 crystals |
从SEM照片可知, 合成的立方体、 四面体、 菱形十二面体Ag3PO4微晶形貌规整, 尺寸均一, 分别具有单一的{100}, {111}, {110}晶面. 根据粒径统计结果, 立方体、 四面体、 菱形十二面体和块体Ag3PO4微晶的粒径分布分别为0.6~1.2, 0.6~1.6, 0.3~0.7和7.8~12.4 μ m.
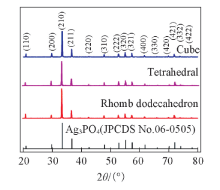
图3为分别具有{100}, {111}, {110}晶面的立方体、 四面体、 菱形十二面体Ag3PO4微晶的XRD谱图. 结果显示, 产物的所有衍射峰位置与Ag3PO4标准卡片一致, 没有杂质峰, 衍射峰半高宽很窄, 表明样品的纯度和结晶性良好.
不同温度下分别具有{100}, {111}, {110}晶面的立方体、 四面体、 菱形十二面体Ag3PO4微晶和块体Ag3PO4微晶在水中的溶解平衡常数Ksp列于表1, 
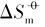
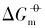
| Table 1 Standard equilibrium constant of Ag3PO4 at different temperatures |
| Table 2 Standard molar dissolve enthalpy and entropy of Ag3PO4 |
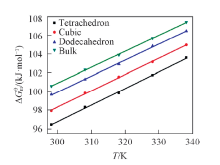 | Fig.4 Relationship between standard molar dissolve Gibbs free energy of Ag3PO4 with different facets and temperatures |
由表1、 表2和图4可知, 温度一定时, 具有{111}, {100}, {110}晶面的Ag3PO4微晶和块体Ag3PO4微晶的Ksp依次降低, 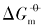
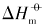
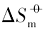
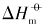
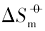
对于同一晶面的磷酸银微晶, 其Ksp和 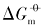
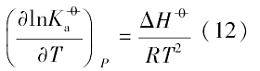
当Δ H> 0时, 物质的溶解平衡常数会随着温度的升高而增大.
Ag3PO4达到溶解平衡时, 其溶解平衡常数Ksp< 1, 则磷酸银溶解是个非自发的可逆过程, 根据热力学方程:
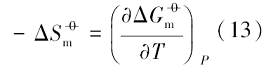
等号的左边大于零, 当温度升高时, 溶解吉布斯自由能也就越大.
以立方体、 四面体、 菱形十二面体和块体Ag3PO4微晶为模型, 基于Ag3PO4微晶晶面的差别, 结合强电解质溶液和溶解热力学理论, 推导出Ag3PO4微晶溶解热力学函数的关系式. 利用电导率仪测定不同形貌Ag3PO4微晶在不同温度下的电导率, 结合动力学、 热力学和热化学循环理论, 获得了Ag3PO4的溶解热力学函数, 并讨论了晶面及温度的影响. Ag3PO4微晶的 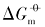
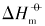
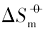
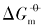
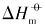
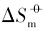
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|