联系人简介: 袁耀锋, 男, 博士, 教授, 博士生导师, 主要从事功能有机分子的设计合成与性能研究. E-mail: yaofeng_yuan@fzu.edu.cn
利用系列含磺酰基的叠氮化物与末端炔反应, 制备了 N-磺酰基三氮唑化合物. 研究结果表明, 硫酸铜/取代硫脲的组合不仅适用于一般的铜催化叠氮端炔环加成(CuAAC)反应, 还可以在水相中高效催化合成 N-磺酰基-1,2,3-三氮唑. 这类反应对水不敏感, 在水相中的反应产率高达99%, 且在空气中室温(25 ℃)下搅拌即可进行. 该方法反应条件温和、 绿色环保、 成本低、 底物普适性广且反应效率高.
The reaction of a series of sulfonyl-containing azides and terminal alkynes indicated that the combination of copper sulfate/substituted thiourea was more suitable for general copper-catalyzed azide-end alkyne ring addition[Cu(Ⅰ) catalyzed azide-alkyne cycloaddition, CuAAC] reaction. The type of reaction was also possible to efficiently catalyze the synthesis of N-sulfonyl-1,2,3-triazole in the aqueous phase. The type of reaction was not sensitive to water and the yield was up to 99% in the aqueous phase. The reaction mixture was stirred in the air under room temperature(25 ℃). The novel system showed high atom-economy and functional-group tolurance. It provided a simple and efficient synthesis method for the synthesis of a series of N-sulfonyltriazoles.
N-磺酰基-1, 2, 3-三氮唑在有机化学、 药物化学和材料化学等领域具有广阔的应用前景[1], 尤其在心血管[2]、 抗过敏[3~5]、 治疗精神类[6]、 抗感染[7]和抗肿瘤[8, 9]等药物的制备方面发挥着重要的作用. 2000年以前, 由于制备三氮唑时官能团的限制, 使三氮唑的研究受限. 21世纪初, 随着点击(Click)化学的出现, 有关三氮唑的研究获得了突破性进展, 铜催化反应也得到了很大的发展[10, 11]. 点击化学是在绿色环境下, 将一些小片段快速并稳定地结合在一起的反应[12, 13], 此反应的强大之处在于其直接的合成方法, 可以简化许多化合物的合成过程, 使铜催化叠氮端炔环加成反应(CuAAC)在多种领域中的使用成为可能[14~18]. 磺酰基叠氮是一类重要的叠氮化合物. 不同于烷基叠氮, 在磺酰基叠氮与炔的反应中, 三氮唑中间体易发生开环反应, 生成α -重氮亚胺中间体; 重氮亚胺再脱除N2气转化为烯亚胺, 而未得到三唑产物. 该重排反应对反应温度、 反应介质和取代基比较敏感. 文献[19, 20, 21]报道了N-磺酰基-1, 2, 3-三氮唑的合成方法, 但大多需要先合成一价铜的催化剂, 步骤繁琐且大多数方法必须采用非质子型的有机试剂作为反应溶剂. 因此, 发展高效、 绿色且简单的方法合成N-磺酰基-1, 2, 3-三氮唑类化合物具有重要的意义. 前期研究[22]发现, 硫酸铜/取代硫脲可以高效催化叠氮化物与炔的环加成反应, 该反应无需再加入其它配体及还原剂, 且该类反应以水为溶剂, 反应条件温和、 绿色, 具有很好的底物普适性. 本文利用硫酸铜/取代硫脲的一价铜催化体系, 高效地催化合成了一系列N-磺酰基-1, 2, 3-三氮唑类化合物, 并考察了该反应在最优条件下的底物普适性及末端炔对反应的影响, 探索了不同取代基的磺酰叠氮化物和芳基炔化合物的反应范围.
邻甲苯磺酰氯、 苄磺酰氯及甲基磺酰氯购于萨恩化学技术(上海)有限公司; 其它磺酰氯化合物和苯乙炔购于上海泰坦科技股份有限公司; 苯胺购于国药集团化学试剂有限公司.
Bruker AVANCE Ⅲ 400型核磁共振波谱(NMR)仪, 瑞士Bruker公司; Thermo-Finnigan ion-trap LCQ质谱(MS)仪, 德国Thermo Finnigan公司; Perkin Elmer Spectrum 2000型红外光谱(FTIR)仪, KBr压片, 美国Perkin Elmer公司; WPS-1B型数字熔点仪, 上海申光公司; VARIO EL cube型元素分析仪, 德国Elementar公司.
目标化合物的合成路线如Scheme 1所示.
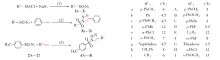 | Scheme 1 Synthetic routes of target compounds Conditions: (1) H2O/acetone, 0 ℃ to r. t., 4 h; (2) CuSO4· 5H2O, L2, H2O, r. t. |
反应底物是含有磺酰基的有机叠氮化物, 直接由相应的磺酰氯与叠氮化钠反应制得. 在250 mL圆底烧瓶中, 将15 mmol NaN3溶于15 mL水中, 置于冰盐浴下搅拌; 将10 mmol磺酰氯溶于30 mL丙酮中, 通过恒压滴液漏斗缓慢滴加到上述烧瓶中; 滴加完毕, 撤去冰盐浴, 于室温下持续搅拌反应4 h; 将反应液减压除去大部分丙酮, 再用乙酸乙酯萃取(20 mL× 4), 收集的有机相用饱和NaCl溶液洗涤, 用无水Na2SO4干燥, 所得粗产品通过柱层析[V(石油醚)∶ V(乙酸乙酯)=50∶ 1]纯化, 得到相应的磺酰叠氮化物1a. 采用相同的方法合成化合物1b~1i. 其理化性质见表1, 核磁共振谱图见本文支持信息图S1图S18.
| Table 1 Appearance, yields and MS data of compounds 1a— 1i, L1— L4, 3a— 3i and 4A— 4I |
参照文献[23]方法制备配体取代硫脲, 其理化性质列于表1, 结构如图1所示.
以对甲基苯磺酰叠氮1a与苯乙炔的环加成反应为模板. 在最初的实验中, 以1 mL H2O作为溶剂, 在室温(25 ℃)下进行反应, 首先改变铜盐的种类进行实验. 由表2中Entries 1~3可见, 在常见的铜盐中, CuSO4· 5H2O与取代硫脲组合的催化效果最好. 值得注意的是, 反应完全未受到水的影响, 在反应中未发现因磺酰叠氮、 末端炔及水的三组分反应而生成酰胺副产物. 由表2中Entries 3~7可见, 配体L2参与反应时, 产率高达99%, 因此确定了硫脲的种类. 在保持其它条件不变的条件下, 改变取代硫脲用量进行反应, 当L2的用量(摩尔分数)由10%降低至1%时, 仍可实现同样高的产率(表2中Entries 8~10). 在保持其它条件不变的条件下, 改变溶剂种类进行反应, 由于受到CuSO4· 5H2O溶解性的限制, 故采用混合溶剂, 即一些常见的有机试剂与水等体积混合. 由表2中Entries 11~16可见, 混合溶剂既未缩短反应时间, 也未提高反应产率, 因此确定水为最佳溶剂. 空白对照实验(表2中Entries 17和18)结果表明, 铜盐与添加剂缺一不可. 通过系列实验, 最终确定了磺酰基叠氮与炔环加成反应的最优条件: CuSO4· 5H2O(10%)为催化剂, 配体L2(1%)为添加剂, H2O(1 mL)为反应溶剂, 在空气中室温(25 ℃)下搅拌反应6 h.
| Table 2 Reaction conditions screening of the target compound* |
以带取代基的磺酰叠氮化合物与苯乙炔的环加成反应为模板, 研究了磺酰叠氮化物反应的范围. 结果(Scheme 1)表明, 取代基的位置对反应并无太大影响(化合物3a~3f). 除苯环外, 还选用萘环、 苄基及烷基磺酰叠氮化物在最优条件下与苯乙炔反应, 均能得到较高的产率(化合物3g~3i). 此外还发现, 该反应受取代基电子效应的影响较大, 尝试用带有硝基苯和三氟甲基苯等吸电子取代基的磺酰叠氮化物作为底物参与反应, 几乎无法得到目标分子. 这是因为其结构中的强吸电子基在与炔发生环加成反应时, 导致产物结构不稳定, 五元环上的N— N键容易断裂随后脱去一分子N2, 形成链状产物N-磺酰基烯酮亚胺中间体. 化合物3a~3i的理化性质见表1, 其中化合物3e为新化合物, m.p. 126~130 ℃. IR(KBr), v/cm-1: 3030, 1420, 780, 720, 690; 元素分析实测值(%, C14H10SClN3O2计算值): N 11.79(13.13), C 51.55(52.54), H 3.39(3.13), S 9.04(10.09), O 13.59(10.01), Cl 10.64(11.10); 1H NMR(400 MHz, CDCl3), δ : 8.33(s, 1H), 8.12(s, 1H), 8.05(d, J=7.6 Hz, 1H), 7.83(d, J=7.2 Hz, 2H), 7.68(d, J=8.0 Hz, 1H), 7.55(t, J=7.6 Hz, 1H), 7.41(dt, J=22.4, 6.8 Hz, 3H); 13C NMR(100 MHz, CDCl3), δ : 147.6, 137.7, 136.1, 135.8, 131.1, 129.3, 129.1, 128.6, 128.5, 126.8, 126.1, 119.1. 图S19~图S36(见本文支持信息)为化合物3a3i的1H NMR谱图.
考察了末端炔对反应的影响, 以对甲基苯磺酰叠氮(1a)与带有取代基的乙炔化合物(2A~2I)的环加成反应为模板, 对带有不同取代基的芳基炔化合物的反应范围进行了研究. 结果(Scheme 1)表明, 一系列芳基炔均能与化合物1a发生环加成反应且产率较高, 苯环上取代基的电子效应及取代位置对反应的影响较小(化合物4A~4D, 4H和4I). 尝试用含杂环的炔进行反应, 发现2-乙炔基吡啶未显示出反应活性, 几乎未得到目标分子, 而3-乙炔基噻吩的反应产率高达99%(化合物4G). 脂肪族炔也是合适的底物, 能以较高的产率生成目标产物(化合物4E), 但其它脂肪族的炔无很好的反应活性. 产物4A4I的理化性质表征结果见表1和图S37~图S56(见本文支持信息).
将硫酸铜/取代硫脲作为高效的一价铜催化体系应用于磺酰叠氮化物与末端炔的环加成反应中. 以水为溶剂, 反应速率未受到影响, 产率达到最高. 该方法反应条件温和、 溶剂绿色、 减小了添加剂的用量, 具有很好的底物普适性, 反应效率较高. 此外, 该反应操作简便, 产物易于分离提纯, 具有较好的工业应用潜力.
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/cjcu20180540.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|



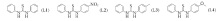
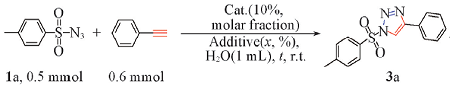 . a. Molar ratio; b. volume ratio; c. column chromatography separation yield; d. no reaction.
. a. Molar ratio; b. volume ratio; c. column chromatography separation yield; d. no reaction.