联系人简介: 苏二正, 男, 博士, 教授, 博士生导师. 主要从事植物资源化学、 酶与生物催化方面的研究. E-mail: ezhsu@njfu.edu.cn
采用深共熔溶剂(Deep eutectic solvents, DESs)法同步提取红景天中红景天苷和酪醇. 首先, 通过对氢键供体(HBD)、 氢键受体(HBA)及二者摩尔比和DESs含水量等因素的设计优化, 获得了同步提取红景天苷和酪醇的最佳DES为乙二醇-乙酰丙酸(摩尔比为1∶1), 含水质量分数为40%, 记为LAEG-40. 然后, 以LAEG-40作提取溶剂, 对提取方法、 料液比、 提取温度及提取时间等因素进行优化, 获得了最佳提取条件: 采用150 r/min搅拌速率提取, 料液比为1∶12.5(g/mL), 提取温度60 ℃, 提取时间65 min. 在此条件下LAEG-40对红景天苷的提取率可达(18.1268±0.1667) mg/g, 酪醇提取率可达(1.5608±0.0240) mg/g. 而在相同条件下, 以水和乙醇作为提取溶剂, 红景天苷提取率分别为(15.1221±0.1342)和(16.3425±0.0897) mg/g, 酪醇提取率分别为(1.1120±0.0389)和(1.1923±0.0423) mg/g, 可见LAEG-40的提取效果明显高于传统溶剂. 研究结果表明, LAEG-40是一种绿色、 高效的红景天苷和酪醇同步提取溶剂, 可用于替代传统溶剂.
A method for simultaneously extracting the salidroside and tyrosol from Rhodiolarosea L. using deep eutectic solvents(DESs) as the extraction solvents was developed in this work. Firstly, the hydrogen bond donor(HBD), hydrogen bond acceptor(HBA), molar ratio of HBA to HBD, and water content were optimized. The optimal DES for the simultaneous extraction was obtained as ethylene glycol-levulinic acid at the molar ratio of 1∶1 and water content of mass fraction of 40%, which was recorded as LAEG-40. Then, taking the LAEG-40 as the extraction solvent, the extraction conditions such as extraction method, solid to solvent ratio, extraction temperature and extraction time were further optimized. The optimal conditions were obtained as follows: stirring extraction at the solid to solvent ratio of 1∶12.5(g/mL) and 60 ℃ for 65 min. Under these conditions, the extraction yields of salidroside and tyrosol reached (18.1268±0.1667) and (1.5608±0.0240) mg/g, respectively. However, under the same conditions, taking water or ethanol as the extraction solvents, the extraction yields of salidroside and tyrosol were (15.1221±0.1342) and (1.1120±0.0389) mg/g, or (16.3425±0.0897) and (1.1923±0.0423) mg/g, respectively. It could be seen that the extraction efficiency of LAEG-40 was obviously higher than those of traditional solvents. The results showed that LAEG-40 was a green and efficient solvent for simultaneous extraction of salidroside and tyrosol, which could be used as a substitute for traditional solvents.
红景天是珍稀的药用植物, 我国红景天储量丰富, 资源拥有量占世界总量的80%以上[1]. 红景天中含有多种生物活性成分, 如苷类、 黄酮类、 挥发油类、 香豆素类、 萜类及生物碱类等, 其中红景天苷和酪醇是最主要的活性成分[2]. 红景天苷可以保护神经细胞, 对抑郁症、 心脑血管疾病有显著疗效. 另外, 红景天苷在抑制癌细胞生长和抵抗病毒方面也有一定效用[3], 可以增强机体免疫力; 其还具有防止肝纤维化等药理活性作用[4]. 红景天苷合成过程的最后一步是酪醇糖基化反应, 故苷元酪醇是红景天苷的前体物质, 其药理活性作用与红景天苷相似[5].
目前, 关于红景天的提取研究主要是针对红景天苷, 提取方法主要有回流提取、 超声提取、 微波提取、 超临界提取、 高压提取和生物酶解提取等, 提取溶剂以水和有机溶剂为主[6, 7, 8, 9, 10, 11, 12]. 这些取方法虽然各有优点, 但存在2个主要问题: (1) 由于红景天苷和酪醇的极性差异, 很难找到一种可以高效同步提取红景天苷和酪醇的溶剂, 从而导致酪醇提取不充分, 残留于提取残渣中造成资源浪费; (2) 使用甲醇、 乙醇等有机溶剂作为提取溶剂, 溶剂消耗量大, 提取温度高、 能耗大, 会有溶剂残留. 因此, 寻求新的溶剂实现红景天苷和酪醇的同步提取, 使提取过程更加绿色环保、 节能高效具有重要意义.
深共熔溶剂(DESs)是一种新型的绿色溶剂, 通常是以一定摩尔比的氢键受体(HBAs)和氢键供体(HBDs)为起始材料, 经一定方法制备的低共熔混合物[13]. DESs与离子液体相似[14], 具有以下特点: (1) 制备简便, 可实现大规模的工业化生产; (2) 易发生生物降解, 环境相容性高; (3) 作为多元体系, 其“ 可设计性” 强, 可以针对不同的应用要求调整组分, 实现高效利用[15]. 基于DESs的诸多优点, 其在化学、 物理、 材料科学、 电化学、 生物质处理及生物分离等领域已得到广泛应用. 目前, DESs已被应用于黄酮类化合物、 芳香烃类化合物和蛋白质的分离提取. Wei等[16]采用微波辅助深共熔溶剂法提取了黄芩中的4种黄酮类化合物. Gu等[17]使用DESs从模拟油中提取苯酚、 甲酚和萘酚3种酚类物质. Xu等[18]采用DESs两相体系对蛋白进行提取分离. 将DESs应用于红景天苷和酪醇的提取研究, 可以通过调节DESs的组成成分及摩尔比精细调控DESs的极性, 从而实现红景天苷和酪醇的同步提取. 另外, DESs在制备过程中不产生废弃物且容易降解, 用于提取分离后还可通过适当的方法回收再利用. Jeong等[19]通过冷冻干燥得到再生DESs, 可重复使用3次.
本文尝试将DESs应用于红景天中活性成分的提取, 通过DESs的调制实现了红景天中红景天苷和酪醇的同步提取(Scheme 1), 期望解决当前提取方法中存在的问题, 提供一种新的红景天中红景天苷和酪醇的绿色高效提取方法.
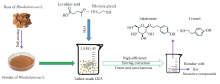 | Scheme 1 Simultaneous extraction of salidroside and tyrosol from Rhodiolarosea L. using deep eutectic solvents |
实验所用原料来自于新疆产红景天根, 生产时间为2017年3月; 甲醇和磷酸为色谱纯, 其它试剂均为分析纯, 购自上海阿拉丁生化科技股份有限公司.
JY-2型恒温搅拌油浴锅(金坛市天竟实验仪器厂); S23-2型恒温磁力搅拌器(上海司乐仪器有限公司); P1201型高效液相色谱仪(HPLC, 大连依利特分析仪器有限公司); TG16A-WS型台式高速离心机(上海卢湘仪离心机仪器有限公司); THZ-320型恒温摇床(上海精宏实验设备有限公司).
1.2.1 原料准备 将红景天根烘干至恒重, 粉碎, 经30及40目筛子筛分后, 得到3040目红景天根粉末, 含水质量分数为5.31%, 装入磨口瓶中并置于干燥器内密闭保存, 备用.
1.2.2 红景天苷和酪醇的HPLC检测 HPLC条件的确定: 参考文献[20]方法, 流动相采用甲醇-磷酸水溶液(体积比20∶ 80), 其中磷酸水溶液中磷酸体积分数为0.2%; 流速1 mL/min; 检测波长230 nm, 柱温30 ℃. 根据色谱分离情况对检测条件进行适当优化.
红景天苷和酪醇标准曲线的制作: 称取一定量的标准品, 用甲醇定容后稀释至相应浓度. 红景天苷的浓度梯度为0, 100, 200, 300, 400, 500, 600, 700, 800, 900和1000 μ g/mL; 酪醇的浓度梯度为0, 30, 60, 90, 120, 150, 180, 210, 240, 270和300 μ g/mL. 以浓度为横坐标, 色谱峰面积为纵坐标绘制二者的标准曲线.
1.2.3 深共熔溶剂的制备 按照不同摩尔比量取所用组分并均匀混合, 于80 ℃加热搅拌, 直至形成透明液体, 于45 ℃放置过夜, 无固体析出, 即可用于红景天苷和酪醇的提取.
1.2.4 红景天苷和酪醇的同步提取 精确称取120 mg红景天根粉末置于2 mL离心管中, 加入1.2 mL提取溶剂, 混合均匀, 在25 ℃, 250 r/min气浴振荡下提取5 min, 然后在10000 r/min转速下离心10 min. 取适量的上层清液用水稀释5倍, 并经0.45 μ m微孔滤膜过滤后, 进行HPLC检测. 为降低DESs的黏度, 所有初筛实验DESs中均加入超纯水, DESs与水的质量比为7∶ 3. 在初筛以及DESs优化过程中的同步提取均按照上述步骤进行.
1.2.5 最佳同步提取DESs的设计 DESs的组成成分不同及其摩尔比的变化会改变DESs的性质, 从而影响提取效果. 按照1.2.3节方法分别用不同的氢键受体(HBA)和氢键供体(HBD)制备了系列DESs, 再按照1.2.4节方法进行同步提取, 考察了不同HBA和HBD对提取率的影响. 在获得最佳HBA和HBD的基础上, 进一步优化HBA和HBD的摩尔比, 最终获得最佳的同步提取DESs条件.
DESs含水量的优化: 选用含水量(质量分数)分别为0, 10%, 20%, 30%, 40%, 50%, 60%, 80%和100%的DESs对红景天苷和酪醇进行同步提取, 在最优含水量附近以5%为间隔进一步优化.
1.2.6 红景天苷和酪醇同步提取条件的优化 提取方法的优化: 选取1.2.5节优化获得的最佳DES体系为提取溶剂优化提取方法. 提取方法分别为静置加热法、 气浴摇床法(150 r/min)、 磁力搅拌法(150 r/min)和水浴摇床法(150 r/min). 同时选取25和60 ℃作为提取温度, 考察加热对提取率的影响.
料液比(红景天粉末质量与DES体积之比, g/mL)的优化: 选取料液比分别为1∶ 5, 1∶ 7.5, 1∶ 10, 1∶ 12.5, 1∶ 15, 1∶ 20和1∶ 30进行优化.
提取温度的优化: 选择提取温度分别为30, 35, 40, 45, 50, 55, 60, 65和70 ℃进行优化.
提取时间的优化: 选择提取时间分别为5, 15, 25, 35, 45, 55, 65, 75, 85和95 min进行优化.
1.2.7 最佳DES与传统溶剂提取效果的比较 当前文献[4~10]报道的用于红景天苷和酪醇提取的溶剂多为水和乙醇, 故分别选取最佳的DES体系、 水和乙醇作为溶剂, 在筛选出的最优提取条件下进行提取操作, 通过比较进一步验证DES的提取效果.
1.2.8 数据分析 实验所得数据采用Excel软件进行分析与处理, 在定量分析中测定3次并取平均值.
经优化获得的HPLC分析条件如下: 依利特Sino Chrom ODS-BP 5 μ m色谱柱(4.6 mm× 200 mm), 流动相为甲醇-磷酸水溶液(体积比18∶ 82), 其中磷酸水溶液中磷酸体积分数为0.2%, 检测波长230 nm, 柱温30 ℃, 流速1 mL/min, 进样量20 μ L. 此条件下获得的对照品和提取样品的HPLC谱图见本文支持信息图S1. 红景天苷的保留时间为10.10 min, 酪醇的保留时间为11.77 min, 2种物质的峰形良好, 且可完全分开.
在最优HPLC条件下, 以红景天苷和酪醇的峰面积(y)为纵坐标, 浓度(x)为横坐标, 得到红景天苷的标准曲线为y=9.0011x+88.3418, R2=0.9926; 酪醇的标准曲线为y=23.7825x-51.7000, R2=0.9979. 2种物质的回归方程在测试浓度范围内均有良好的线性关系, 可用于定量分析.
2.2.1 DESs组分种类对提取率的影响 参照文献[17, 18]方法, 先选取氯化胆碱作为HBA, 分别以8种醇类、 19种酸类、 5种糖类、 3种胺类、 1种酚类物质和1种杂环化合物作为HBD来制备基础DESs. 基础DESs的稳定性和流动性数据见本文支持信息表S1.
根据HBDs分析结果, 8种醇类中有4种能形成流动性好的透明液体, 2种能形成黏稠的透明液体, 2种不能制备成稳定的DESs; 5种糖类中有2种能形成黏稠的透明液体, 3种不能制备成稳定的透明液体; 9种酸类中有5种能形成流动性好的透明液体, 3种能形成黏稠的透明液体, 1种不能制备成稳定的透明液体; 其它5种HBDs中有2种能形成流动性好的透明液体, 3种不能制备成稳定的DESs. 因此, 在氯化胆碱作为HBA的情况下, 酸类作为HBDs最容易制备成流动性好的DESs透明液体, 其次是醇类较容易与氯化胆碱形成稳定DESs, 而糖类与氯化胆碱形成DESs则比较困难.
将上述制备成功的20种DESs用于同时提取红景天根中的红景天苷和酪醇, 用HPLC分别检测这2种物质的含量, 结果如图1所示.
由图1可见, 不同组分的DESs对于红景天苷和酪醇的提取率不同, 这可能与DESs的极性和黏度有关. DESs的极性与待提取物质极性越相近, 提取率越高; DESs黏度越低, 表面张力越低, 流动性越好, 待提取物的传质速率越快, 提取率越高[21, 22]. 糖类作为HBDs的DESs对红景天苷和酪醇的提取率较低, 这可能是因为糖类与氯化胆碱形成的DESs较为黏稠, 流动性差, 传质阻力高; 而酸类和醇类作为HBDs制得的DESs流动性较好, 故提取率高.
酸类和醇类作为HBDs的DESs对红景天苷和酪醇的提取率明显优于糖类、 尿素和间苯二酚HBDs(图1). 考虑到酸类更容易与氯化胆碱制备成流动性较好的透明液体及其对红景天苷和酪醇提取率高的特性, 选取以上全部8种酸类与甜菜碱制备DESs. 醇类作为HBDs制备DESs较容易, 其中乙二醇、 1, 2-丙二醇及1, 3-丁二醇与氯化胆碱制备的DESs提取率明显优于其它3种, 故选取这3种醇类与甜菜碱制备DESs. 糖类HBDs制备的DESs流动性不好, 因此选取提取率最高的果糖制备甜菜碱基DESs. 尿素和间苯二酚作为HBDs制备的DESs对于红景天苷提取率不高, 但由于其制成的DESs流动性较好, 且对酪醇的提取率较高, 故也考虑进行下一步的制作.
以酸类作为HBDs制备的甜菜碱基DESs流动性和稳定性最好, 其次是醇类, 果糖与甜菜碱制备的DESs流动性最差, 而尿素与间苯二酚制备的DESs稳定性差, 不能用于提取(见本文支持信息表S2). 将其中制得的7种DESs用于同时提取红景天根中的红景天苷和酪醇, 结果如图2所示.
 | Fig.2 Extraction yields of the betaine based DESs for salidroside(A) and tyrosol(B) a. DES-28; b. DES-31; c. DES-32; d. DES-33; e. DES-34; f. DES-37; g. DES-38. |
流动性较好的酸类DESs提取率总体高于醇类和糖类DESs, 流动性最差的糖类DES31提取率最低. 酸类DESs中由丙二酸与甜菜碱制备的DES33提取率明显高于其它DESs, 可能是因为其流动性好, 且极性与红景天苷和酪醇相近.
综合分析氯化胆碱基DESs和甜菜碱基DESs的提取结果可知, 以酸类和醇类为HBDs的DESs提取效率总体较高. 分别选取红景天苷提取率≥ 5.5 mg/g且酪醇提取率≥ 0.45 mg/g的醇类(乙二醇、 1, 2-丙二醇和1, 3-丁二醇)HBDs, 红景天苷提取率≥ 8 mg/g且酪醇提取率≥ 0.7 mg/g的酸类(丙二酸、 乙酰丙酸和戊二酸)HBDs, 以摩尔比1∶ 1混合制成9种DESs(DESs-42~DESs-50, 见本文支持信息表S3. 以酸类为组分制备的DESs记为组分1; 以醇类为组分制备的DESs记为组分2). 由表S3可见, 9种DESs均为流动性、 稳定性较好的透明液体, 对红景天苷和酪醇的提取率见图3. 有机酸-醇类DESs的提取率总体高于氯化胆碱基DESs和甜菜碱基DESs, 这可能是由于有机酸-醇类DESs的流动性好, 传质效率高, 且其极性与红景天苷和酪醇相近所致. 对组分1进行分析, 在组分2相同的情况下, 由丙二酸制备的DESs提取率最高, 其次是乙酰丙酸, 戊二酸最低. 其原因可能是丙二酸碳链长度最短, 亲水性更好, 故提取率最高; 戊二酸碳链长, 制成的DESs疏水性较高, 故提取率最低. 对组分2进行分析, 在组分1相同的情况下, DESs提取率随着组分2碳链长度的增加而降低. 其原因可能是醇类亲水性与碳链长度成反比, 从而影响了DESs的亲水性, 而红景天苷是亲水的, 酪醇是适度亲水的, 因此产生了此现象.
 | Fig.3 Extraction yields of the DESs formed between different organic acids and lcohols for salidroside(A) and tyrosol(B) a— i: DES-42; DES-43; DES-44; DES-45; DES-46; DES-47; DES-48; DES-49; DES-50. |
2.2.2 DESs组分的摩尔比对提取率的影响 由2.2.1节中DESs的提取结果可知, 红景天中红景天苷的含量高于酪醇, 且不同DESs对红景天苷和酪醇的提取率影响趋势基本一致, 因此选取红景天苷为主要指标, 酪醇为辅助指标, 考察DESs组分的摩尔比对提取率的影响. 选取2.2.1节中红景天苷提取率≥ 12 mg/g的DESs进行摩尔比优化, 共有4种DESs, 分别是甜菜碱-丙二酸(DES-33)、 乙二醇-丙二酸(DES-42)、 乙二醇-乙酰丙酸(DES-44)和1, 2-丙二醇-丙二酸(DES-45). 其中, DES-33的HBA/HBD优化摩尔比为1∶ 1~1∶ 5, 其它3种有机酸因无法区分HBA和HBD, 故两组分的优化摩尔比为1∶ 3~3∶ 1, 不同摩尔比的DESs组分见本文支持信息表S4. 某些组分的DESs在摩尔比不适当的情况下会形成后析出, 可能是由于产生的氢键不稳定, 导致氢键力弱所致[23]. 将表S4中制备的不同摩尔比DESs用于同步提取红景天苷和酪醇, 结果如图4所示. 乙二醇-乙酰丙酸混合制备的DES-44对红景天苷和酪醇的提取率总体最高, 其它3种DESs的提取率明显低于DES-44, 且丙二酸的量越少, 提取率越高, 这可能是因为丙二酸为固体粉末, 用量越多制备的DESs黏度越大, 从而影响提取率. 另外, DESs的摩尔比也会影响各组分与提取物之间的氢键作用力、 范德华力以及表面张力等作用力, 进而影响提取率.
 | Fig.4 Extraction yields of several DESs with different component molar ratios for salidroside(A) and tyrosol(B) |
2.2.3 DESs含水量的优化 向DESs中添加水可以降低DESs的黏度, 提高传质效率; 此外, 水分子极性大, 还起到调节DESs极性的作用[24]. 选择2.2.2节中红景天苷提取率≥ 13.0 mg/g的DESs进行含水量优化, 符合该条件的是乙酰丙酸与乙二醇按不同摩尔比制备的4种DESs. 优化的含水质量分数区间为0~100%, 其中0~60%之间按10%递增; 60%~100%之间按20%递增; 接近最优的含水量处, 以5%为间隔进一步优化. 结果表明, 随着含水量逐渐增加, 不同DESs对红景天苷和酪醇的提取率总体呈现先升高后降低再趋于稳定的趋势. 一方面可能是红景天苷和酪醇的极性介于水和DESs之间, 而含水量影响了DESs体系的极性, 溶剂体系极性与待提取物质越接近, 提取率就越高; 另一方面, 含水量升高, DESs体系黏度下降, 流动性变好, 与物料的传质效率提高, 故提取率就越高, 结果列于本文支持信息表S5. 分析DESs对红景天苷的提取结果可知, 乙二醇-乙酰丙酸(摩尔比为1∶ 3)在含水量为55%时提取率最高[(15.3122± 0.4043) mg/g]; 乙二醇-乙酰丙酸(摩尔比为1∶ 1)在含水量为40%时提取率次之[(14.6716± 0.2619) mg/g]. 2种DESs对红景天苷提取率无显著性差异, 考虑到DESs制备原料的经济性, 乙酰丙酸的价格是乙二醇的30倍以上, 故选择乙酰丙酸使用量较少的后者进行下一步实验.
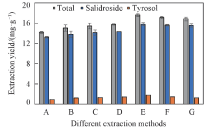
2.3.1 提取方法的筛选 以2.2节中筛选出的最佳DES体系(乙二醇-乙酰丙酸, 摩尔比1∶ 1, 含水质量分数40%, 记为LAEG-40)作为同步提取溶剂, 对静置加热法、 水浴摇床法、 气浴摇床法及磁力搅拌法4种不同提取方法进行筛选.
除静置加热法外其它3种方法转速均为150 r/min, 并选取2种温度(25和60 ℃)探究加热对提取率的影响. 由图5可见, 温度相同时, 气浴摇床法和磁力搅拌法对2种物质的提取效果要优于水浴摇床法. 气浴摇床法和水浴摇床法同样是振荡提取, 提取效果却不同, 原因可能是气浴摇床法是将提取管平置贴在振荡平台, 而水浴摇床法是将提取管直立插在振荡网格中. 因此, 在相同转速条件下, 气浴摇床法振荡平面大, 有利于传质, 从而提取效果更好. 磁力搅拌法是将物料的混匀操作实施到提取容器的内部, 传质更加有效. 对于同一种提取方法, 温度为60 ℃时的提取效果优于25 ℃, 说明加热可以提高料液的传质效果, 从而提高提取率. 综上, 选取气浴摇床法和磁力搅拌法2种方法进行下一步实验.
2.3.2 料液比的影响 料液比的影响结果如图6所示. 随着提取溶剂LAEG-40量的增大, 红景天苷的提取率在料液比低于1∶ 12.5时先提高后趋于稳定. 由此可推断, LAEG-40的用量越大, 红景天粉末与溶剂接触越充分, 传质效果越好, 扩散速度越快, 提取率也就越高; LAEG-40的量较少时, 传质不够充分, 溶质的扩散能力被削弱, 物料与溶剂在提取过程中逐渐变成糊状, 给提取完成后溶剂与物料的分离带来了困难. 当料液比达到1∶ 12.5时, 红景天粉末在提取溶剂中完全分散, 与溶剂充分接触, 故继续增大提取溶剂的量对提取效率无影响, 提取率趋于稳定. 结果表明, 采用气浴摇床法时, 最优料液比为1∶ 20, 红景天苷的提取率为(17.2525± 0.0691) mg/g; 采用磁力搅拌法时, 最优料液比为1∶ 12.5, 红景天苷的提取率为(17.7329± 0.6235) mg/g. 可见, 磁力搅拌法优于气浴摇床法, 且两者存在显著差异. 故选取磁力搅拌法进行下一步实验, 该方法的最优料液比为1∶ 12.5.
 | Fig.6 Effect of solid/solvent ratio on the extraction yields of salidroside and tyrosol air-bath shaking(A) and stirring(B) at 150 r/min and 60 ℃ for 5 min, respectively |
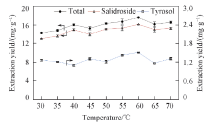
2.3.3 温度的影响 温度对提取效果的影响如图7所示. 随着温度逐渐升高, 红景天苷的提取率总体呈现上升趋势, 直至温度上升至60 ℃后, 红景天苷的提取率略有下降后趋于稳定. 温度升高提高了LAEG-40的流动性, 降低了黏度, 分子间的热运动加快, 使LAEG-40的溶解能力提高, 溶剂的扩散能力也得以提高; 温度过高时提取率略有下降后趋于稳定, 推测是因为高温对于红景天苷和酪醇2种活性成分的稳定性有影响, 或是因为随着温度升高, 红景天中的其它成分溶出, 使提取溶剂变得黏稠, 流动性变差, 导致红景天苷和酪醇提取率降低. 因此, 选取60 ℃作为最优温度进行下一步优化.
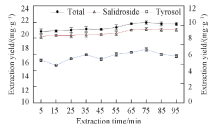
2.3.4 提取时间的影响 图8是在料液比为1∶ 12.5, 磁力搅拌转速为150 r/min, 提取温度为60 ℃条件下获得的提取时间曲线. 可见, 提取时间越长, 2种物质的提取率越高, 提取时间达到65 min后提取率基本趋于稳定, 红景天苷的提取率为(18.1268± 0.1667) mg/g, 酪醇的提取率为(1.5608± 0.0240) mg/g. 随着提取时间的延长, 物料与LAEG-40接触越充分, 传质交换越完全, 红景天苷和酪醇的溶出量更多. 提取时间达到一定程度后, LAEG-40中溶解的各种成分达到饱和状态, 溶剂黏度增加, 提取体系逐渐变成糊状, LAEG-40的溶解能力降低, 提取率不再上升; 也可能是由于物料中的红景天苷和酪醇已经接近完全提取, 提取时间继续延长也无法溶出更多的红景天苷和酪醇. 在提取时间达到75 min后, 酪醇的提取率出现了略微下降. 酪醇是一种活性氧化物的抑制剂, 尤其是在较高温度下自身容易氧化[25], 分析提取率下降的原因可能是提取时间较长, 温度较高导致酪醇发生了氧化反应.
在最佳提取条件下, 对比了LAEG-40、 乙醇和水对于红景天苷和酪醇的同步提取效果, 结果如表1所示, LAEG-40和乙醇的含水量均为40%. 对红景天苷和酪醇2种活性成分来说, 3种提取溶剂的提取效果顺序为LAEG-40> 乙醇> 水. 其中, 乙醇和水的提取效果相近, 而LAEG-40对2种成分的提取率明显高于乙醇和水. 水的提取率低, 推测是虽然其流动性最好, 但极性过高, 与红景天苷和酪醇的极性相差较大; 乙醇的流动性比水略差, 与水混合后可能极性更接近目标提取物, 所以提取率稍高, 但乙醇易挥发, 在提取过程中有损失; 经过系统优化调制的LAEG-40极性与红景天苷和酪醇最为相近, 因而提取率最高, 且提取过程中溶剂几乎无损失, 验证了DESs的绿色高效. 筛选出的最优LAEG-40可应用于红景天苷和酪醇的同步提取, 且提取率明显优于传统溶剂.
| Table 1 Comparison of the extraction efficiency of LAEG-40 with the conventional solvents under the optimized extraction conditions |
目前, 关于红景天苷的提取研究已有大量报道. 与文献报道的超声提取法[26]和微波提取法[27]相比, 本研究采用LAEG-40作为提取溶剂建立的提取方法, 除提取溶剂绿色高效外, 还具有不产生噪声、 不产生辐射、 料液比高、 溶剂使用量小、 提取时间短、 能耗低及提取率高等优点. 另外, 本研究在提取红景天苷的同时, 还同步提取了酪醇, 减少了活性物质的损失, 而迄今尚未见文献报道这2种物质的同步提取.
采用DESs实现了红景天根中红景天苷和酪醇的同步提取. 首先, 建立了红景天苷和酪醇的HPLC同时检测方法, 红景天苷出峰时间为10.10 min, 酪醇出峰时间为11.77 min. 然后, 以红景天苷为主要评价指标, 酪醇为辅助指标, 对DESs进行了设计优化. 经过一系列DESs组分的筛选和摩尔比优化后, 确定了乙二醇-乙酰丙酸(摩尔比1∶ 1)作为提取的最佳DES. 为降低DES的黏度, 进行了含水量优化, 得出最佳含水质量分数为40%. 以最佳的LAEG-40为溶剂优化获得了最佳提取条件: 150 r/min转速下搅拌提取, 料液比1∶ 12.5(g/mL), 提取温度60 ℃, 提取时间65 min. 在此条件下LAEG-40对红景天苷的提取率可达到(18.1268± 0.1667) mg/g, 酪醇提取率可达到(1.5608± 0.0240) mg/g, 明显高于传统提取溶剂乙醇和水的提取率, 验证了DES的绿色高效性.
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/cjcu20180669.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|