联系人简介: 冯钰锜, 男, 博士, 教授, 博士生导师, 主要从事色谱质谱分析研究. E-mail: yqfeng@whu.edu.cn
采用静电纺丝技术制备了SiW11掺杂的二氧化硅纳米纤维(SiW11/SiO2)材料, 其中掺杂的SiW11质量占纤维质量的7.83%, 制备的SiW11/SiO2材料尺寸均一, 在考察的pH范围内带负电, 与未掺杂SiW11的二氧化硅纳米纤维相比, SiW11/SiO2材料表现出强阳离子交换作用, 能有效萃取尸胺和腐胺. 在最优条件下, 建立了注射器分散固相萃取(In syringe dSPE)-超高效液相色谱-串联质谱联用(UHPLC-MS/MS)检测拟南芥样品中多胺的方法. 结果表明, 尸胺和腐胺分别在10~1000和20~1000 ng/mL浓度范围内具有良好的线性关系( R2≥0.9950), 检出限和定量限分别为0.5~0.9和1.6~3.0 ng/mL. 将该方法应用于拟南芥样品中尸胺和腐胺的检测, 加标回收率在87.5%~111.3%之间, 相对标准偏差RSD<5.0%. 建立的SiW11/SiO2制备方法解决了多金属氧酸盐(POM)在修饰改性过程中存在的制备繁琐、 固载量少的问题, 拓宽了POM在分离领域中的应用.
SiW11 incorporated SiO2 nanofibers(SiW11/SiO2) was prepared by electrospinning technology. The mass of incorporated SiW11 accounted for 7.83% of nanofibers. SiW11/SiO2 nanofiber possessed uniform structure with the diameter about 450 nm, and was negative charged in the pH range of 1.0—11.0. Compared with SiO2 nanofibers, the SiW11/SiO2 nanofiber exhibited stronger cation-exchange interactions to extract PUT and CAD. Under the optimized condition, an in-syringe dSPE-UHPLC-MS/MS method for rapid and selective detection of polyamines from plants was established. The limits of detection(LODs) for the target CAD and PUT ranged from 0.5 ng/mL to 0.9 ng/mL, and the linear range was 10—1000 ng/mL and 20—1000 ng/mL with determination coefficients( R2) higher than 0.9950. The recoveries ranged from 87.5% to 111.3% with relative standard deviations(RSDs) of 1.9%—7.2%. The proposed method can be used to detect the trace CAD and PUT in Arabidopsis.
多胺(Polyamines)是指包含2个及2个以上氨基的脂肪族有机小分子化合物[1], 其广泛分布于植物体中, 具有调节植物生长和发育的作用[2, 3]. 多胺含量过低可能抑制植物的生长, 进而导致细胞凋亡; 而含量过高则可能导致植物过度增殖, 具有毒害作用[4]. 因此, 植物中多胺含量的检测对于了解植物生长发育及其抗胁迫能力具有重要意义[5, 6, 7, 8, 9].
目前, 多胺的检测方法主要有气相色谱-质谱联用(GC-MS)、 高效液相色谱-紫外检测器/光电二极管阵列检测器/荧光检测器(HPLC-UV/PDA/FLD)联用、 胶束电泳-激光诱导荧光检测技术(MEKC-LIF)以及免疫分析等[13, 8, 9, 10, 11, 12, 13, 14]. 由于多胺本身不含有生色基团, 因此通过液相色谱联用方法常用的紫外或者荧光检测器进行检测时, 为了提高检测灵敏度, 需对多胺进行HPLC柱前或柱后衍生, 再利用紫外或荧光检测器进行定量分析. 但衍生步骤的增加导致检测时间显著增长, 同时衍生产生的副产物易对检测造成干扰[8, 10, 11, 12], 而将HPLC与质谱联用可以解决上述问题, 并可根据其质谱特征碎片进行定量分析. 由于植物样品基质复杂, 多胺在进行常规的色谱分离检测前需进行一定的样品前处理. 迄今, 已有多种样品前处理技术被用于多胺的萃取, 如液-液萃取[1]、 固相萃取[13]、 中空纤维液膜萃取[8]及固相微萃取[13]等. 我们在文献[15]中提出的注射器分散固相萃取(In syringe dSPE)具有成本低、 溶剂耗量小、 通量高以及操作简便等优点, 将纤维萃取材料装填于注射器中可用于多种化合物的高通量、 快速萃取分析.
多金属氧酸盐(POM)指含氧酸盐经脱水缩合, 通过氧桥连接具有一定空间结构的金属氧簇类化合物[16]. 由于其优异的热稳定性、 氧化还原性以及强酸性等物理化学性质, POM已被广泛应用于催化、 医学及材料等领域[16, 17, 18, 19, 20, 21, 22]. 基于POM丰富的几何结构及可修饰性, 且其表面存在大量负电荷, 有望作为离子交换吸附剂应用于分析化学领域. 然而, POM存在修饰改性时反应慢且难以从溶液中分离等问题[22], 故通常将其固载到具有较大比表面的基质材料上, 如硅胶、 碳材料和沸石等, 以实现异相催化反应. 但传统的固载方式存在着固载效率低、 流失严重的问题. Xiao等[22]采取化学键合的方式, 将POM以共价键固载于基质材料表面, 该方法弥补了传统涂覆方法的不足, 但键合过程反应步骤繁多且操作复杂, 因此, 有必要开发出新的POM固载基质的方法.
静电纺丝法是将预聚液在静电力作用下拉伸形成超细纳米纤维的方法[23, 24], 该方法成本低、 操作简单且产量高. 二氧化硅预聚液是硅烷偶联试剂以及聚合物经过溶胶凝胶化得到的具有一定黏度和导电率的溶胶. 在预聚液中加入纳米颗粒, 可以通过静电仿丝制备掺杂纳米粒子的纤维材料[24].
本文采用静电纺丝技术将SiW11均匀掺杂于纳米SiO2纤维材料中, 制备了SiW11掺杂的纳米纤维材料(SiW11/SiO2), 弥补了已报道的POM固载方法的不足. 将该材料装填于注射器管中, 通过注射器分散固相萃取模式用于拟南芥植物样品中尸胺(CAD)和腐胺(PUT)(结构见Scheme 1)的萃取分析研究.
腐胺(PUT)、 尸胺(CAD)和1, 6-己二胺(内标, IS)购于阿拉丁(上海)试剂公司; Na2SiO3· 9H2O和 NaWO4· 2H2O购于上海化学试剂公司; 色谱纯甲醇(MeOH)和乙腈(ACN)购自德国Merck KGaA公司; 聚乙烯醇(PVA)、 甲酸(FA)、 盐酸(HCl)和氢氧化钠(NaOH)均为分析纯, 购于国药集团化学试剂有限公司(上海); 三氟乙酸(TFA)购自Sigma-Aldrich公司(美国); 四乙氧基硅烷(TEOS)购于北京百灵威科技有限公司. 实验用水通过Milli-Q仪器净化(美国Millipore公司). PUT和CAD标准溶液均由一定量0.01 mg/mL PUT和CAD溶液稀释于0.1 mol/L HCl水溶液中, 并储存于-20 ℃冰箱中.
纤维的形貌通过FEI型扫描电子显微镜(美国希尔斯伯勒公司)进行表征; 表面电势经NanoZS ZEN 3600型纳米颗粒和表面电势分析器测量; SiW11中钨元素含量通过UV-2700型紫外-可见分光光度计(日本岛津公司)定量分析. 超高效液相色谱-串联质谱联用仪(UHPLC-ESI-MS/MS, 日本岛津公司)配有LC-30AD型泵、 DGU-20A5R型脱气机、 MS-8045型质谱检测仪、 SIL30AC型自动进样器和CTO-20A型柱温箱.
采用UHPLC BEN HILIC型色谱柱(100 mm× 2.1 mm i.d., 5 μ m; 美国Waters公司). 流动相A为含0.1% FA 的20 mmol/L甲酸铵, 流动相B为乙腈. 流动相梯度: 0~1 min 95%B, 1~3 min 95%~85%B, 3~4 min 85%B, 4~6 min 85%~50%B, 6~10 min 50%B, 10~10.5 min 50%~95%B, 10.5~20 min 95%B; 流速0.4 mL/min, 柱温40 ℃, 进样体积10 μ L. 对CAD和PUT在正离子模式下采取多反应监测(MRM)模式进行定量分析, 相关质谱参数优化结果见表1. 离子源条件: 雾化气流速3 L/min, 干燥器流速15 L/min, 脱溶剂管温度250 ℃, 加热模块温度400 ℃.
| Table 1 Optimized parameters of multiple reaction monitoring(MRM) mode for analysis of polyamines* |
1.3.1 缺位Keggin型POM材料的制备 缺位Keggin型POM(K8SiW11O39, SiW11)参考文献[23]方法制备. 向200 mL 30%(体积分数)乙腈水溶液中加入310 μ L乙烯基三甲氧基硅烷(2 mmol), 搅拌5 min后, 加入3.0 g SiW11(1 mmol)固体粉末, 待溶液澄清后, 调节pH值至1.0, 继续搅拌反应24 h. 将得到的白色沉淀用滤膜过滤, 收集滤液并旋转蒸发浓缩至60 mL. 向上述浓缩液中加入3.0 g CTAB, 得到白色沉淀, 依次用水、 异丙醇及乙醚洗涤, 真空干燥待用.
1.3.2 SiW11/SiO2纳米纤维材料的制备 如Scheme 2(A)所示, 采用静电纺丝法制备了SiW11/SiO2纳米纤维材料. 首先, 将1.0 g SiW11溶解于7.5 mL 水和400 μ L 4 mol/L HCl混合溶液中, 再加入8.0 g TEOS, 室温下搅拌30 min后, 置于4 ℃冰箱中12 h. 将上述溶液转移到100 mL 圆底烧瓶中, 加入30 g 8%(质量分数) PVA水溶液, 于60 ℃油浴下搅拌加热反应3 h, 即得黏度适中的预聚液. 将预聚液装入直径为10.56 mm的注射器中, 用流速为0.4 mL/h的蠕动注射泵驱动. 以接地的铝片覆盖一层锡箔纸作为接收器和对电极, 注射器尖端到接收器距离为15 cm. 在注射器针尖上附加15 kV电压, 预聚液由蠕动注射泵驱动, 并在注射器针尖尖端形成泰勒锥, 由电场力作用下形成纳米纤维并接收于锡箔纸上. 收集制得的纳米纤维, 于120 ℃下老化12 h. 将得到的纳米纤维材料用无水乙醇清洗后, 于60 ℃下烘干, 待用.
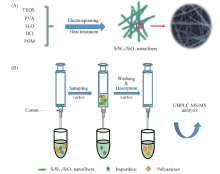 | Scheme 2 Preparation of SiW11/SiO2 nanofibers(A) and the procedure of insyringe dSPE for the extraction of polyamines(B) |
SiO2纳米纤维的制备方法与SiW11/SiO2纳米纤维类似, 区别是预聚液中未添加SiW11.
收集拟南芥叶片组织, 加液氮研磨成粉末状. 准确称取50 mg 鲜重植物组织粉末, 加入500 μ L 8%(体积分数)甲酸水溶液, 冰浴下提取1 h; 离心(7000 r/min)分离10 min, 收集溶液; 将10 μ L离心后的溶液加入1.0 mL 20 mmol/L磷酸缓冲溶液(pH=6.0)中进行萃取. 为了考察方法的准确度和精密度, 将10 μ L植物提取离心后的溶液加入到1 mL添加了一定量0.01 mg/mL PUT和CAD溶液的20 mmol/L磷酸缓冲溶液(pH=6.0)中, 制得含不同浓度PUT和CAD的萃取上样液进行萃取分析.
1.5.1 萃取过程 如Scheme 2(B)所示, 将4 mg SiW11/SiO2纳米纤维填装于底端封有棉花的2 mL注射器中. 通过活塞吸取0.5 mL 20 mmol/L磷酸缓冲盐(pH=6.0), 采取涡旋方式使纳米纤维材料与溶液充分接触, 而后用活塞将溶液推出; 接着吸取1.0 mL样品溶液, 涡旋萃取2 min; 用 1 mL 水溶液清洗, 最后用0.2 mL 三氟乙酸水溶液(体积分数10%)解吸3 min. 将解吸液冷冻旋干, 用100 μ L 水溶液复溶, 同时加10 μ L 100 ng/mL的1, 6-己二胺作为内标, 用UHPLC-MS/MS检测, 进样量为10 μ L.
1.5.2 紫外分光光度法分析 钨元素紫外-分光光度法测定过程参照文献[24]方法进行. 分别量取100 μ L钨酸钠标准溶液(10, 20和300 mg/L)于试管中, 向其中加入0.4 mL 250 g/L KSCN溶液, 再依次加入0.7 mL 12 mol/L盐酸和0.8 mL 9 mol/L硫酸溶液, 得到溶液Ⅰ . 取1.4 mL 12 mol/L HCl加入15 mL离心管中, 依次加入0.3 mL质量浓度为18%的TiCl3溶液和8.3 mL二次水, 将所得溶液体系混合均匀, 制得溶液Ⅱ . 向溶液Ⅰ 中加入0.3 mL溶液Ⅱ , 再加入三次水至5 mL, 冷却20 min后取 1 mL进行紫外光谱定量检测, 检测波长为430 nm. 称取10 mg SiW11/SiO2纳米纤维溶解于1 mL 20%HF水溶液中, 取100 μ L样品溶液按上述操作配制成5 mL待测液, 取1 mL进行紫外光谱测定.
通过扫描电子显微镜对SiW11/SiO2纳米纤维材料的形貌进行表征, 结果如图1所示. 可见纤维表面光滑且尺寸均一, 纤维尺寸在400500 nm之间.
SiW11/SiO2纳米纤维材料中W的含量通过硫氰酸盐分光光度法测定[25]. 钨元素吸光度(A)与其浓度之间的线性方程为A=0.02214c-0.01621(R=0.9994)[c(μ g/mL)为标准溶液中NaWO4· 2H2O的浓度]. 通过下式对SiW11/SiO2纳米纤维中的SiW11含量(
式中:
SiW11的掺杂使SiW11/SiO2纳米纤维材料具有较强的阳离子交换作用. 为评价该纤维材料的萃取性能并获得最佳的萃取效率, 对萃取参数进行了优化, 包括材料用量、 上样液的pH值、 上样时间、 解吸液组成、 解吸体积以及解吸时间等.
2.2.1 材料的用量 材料用量影响着目标物的萃取效率, 材料用量过少则无法达到预期萃取效果, 用量过多则可能导致目标物的不可逆吸附, 实验考察了材料用量对尸胺和腐胺萃取效率的影响[图3(A)]. 结果表明, 目标物在所选材料用量(2~10 mg)范围内萃取效率保持一致. 为了保证材料称量的准确度, 选取4 mg进行后续实验.
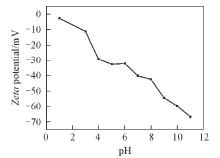
2.2.2 上样液pH值 目标物的带电性质受溶液pH值的影响, 可以以分子或离子形式存在于样品溶液中. 实验考察了20 mmol/L pH=3.0~7.0的磷酸盐缓冲溶液上样液对目标物萃取效率的影响. 从图3(B)可以看出, 在pH=3.0~7.0范围内, 随着pH值的增加, 2种目标物保持较高的萃取效率且无明显变化. 这可能是因为CAD和PUT的pKa值分别为10.9和10.7, 在整个考察pH 范围内目标物带正电, 萃取材料带负电荷, 分析物与吸附材料之间存在强阳离子交换作用, 从而保持较高的萃取效率. 因此, 选取pH=6.0进行后续实验.
2.2.3 萃取时间 实验考察了1~5 min的上样时间对目标物萃取效率的影响. 如图3(C)所示, 目标物的萃取回收率随着上样时间的延长基本无变化, 在1 min内即可完成目标物的解吸. 为避免操作误差, 选取2 min作为上样时间进行后续实验.
2.2.4 解吸液的组成及体积 基于强阳离子交换作用, 多胺被萃取于SiW11掺杂纳米纤维上. 因此, 考察了解吸液中不同浓度三氟乙酸(TFA)水溶液(体积分数1%~20%)对目标物萃取效率的影响. 如图3(D)所示, 随着TFA浓度的增加, 萃取效率不断增大, 当TFA含量为10%时, 萃取效率达到平台. 因此, 选取10% TFA作为最终解吸液. 图3(E)结果显示, 200 μ L解吸液足以完成目标物的解吸, 因此选取200 μ L解吸液用于后续实验.
2.2.5 解吸时间 考察了解吸时间对目标物萃取效率的影响, 结果如图3(F)所示. 目标物的萃取回收率随着解吸时间的延长无明显变化. 因此, 选取3 min作为解吸时间以进行后续实验.
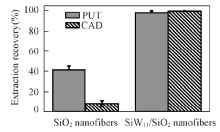
比较了添加和未添加SiW11的二氧化硅纳米纤维材料对CAD和PUT的萃取能力. SiW11/SiO2纳米纤维具有强阳离子交换作用, 而SiO2纳米纤维表面含有一定量硅羟基, 存在弱阳离子交换作用. 选取20 mmol/L磷酸盐缓冲溶液(pH=6.0)作为上样液, 比较了2种纳米纤维材料对CAD和PUT的萃取能力. 如图4所示, SiW11/SiO2纳米纤维萃取后的剩余液中目标物含量很少, 基本上保留在材料中; 而对于SiO2纳米纤维, 大部分目标物仍然在剩余溶液中, 未被萃取到材料上. 以上结果表明, 目标物通过强阳离子交换作用被萃取到SiW11/SiO2纳米纤维上, SiW11在萃取过程中起主要作用.
SiW11/SiO2纳米纤维作为注射器分散固相萃取新材料, 其制备重现性是影响多胺萃取分析方法的实用性及有效性的重要因素. 实验中制备了3批SiW11/SiO2纳米纤维材料, 将每批材料分3份用于CAD和PUT的萃取分析. 材料的制备重现性通过批内不同批次材料(批间)和同一批3份材料(批内)对多胺的萃取效率的相对标准偏差来表示, 其批次间的相对标准偏差分别为1.37%和0.61%; 批次内的相对标准偏差分别为0.93%和2.02%. 此结果表明, 该纳米纤维材料具有较好的制备稳定性.
对实际样品中目标物的基质效应进行了考察. 具体计算方式是, 用添加CAD和PUT标准溶液后的植物样品中目标物浓度与未添加CAD和PUT标准溶液的植物样品中目标物浓度之差除以标准样品中目标物的浓度. 植物样品中CAD和PUT的基质效应分别为103.8%和87.8%, 相对标准偏差分别为2.5%和9.8%, 说明该方法可以用于实际样品中多胺的检测.
通过在空白拟南芥叶基质中加入浓度为10~1000 ng/mL的多胺标品, 对本文方法的线性进行考察. 平行测定3次, 以目标物与内标峰面积比值对浓度绘制线性曲线. 如表2所示, 其线性相关系数R2≥ 0.9950. 检出限和定量限的定义为分析物信噪比为3和10对应的目标物浓度, 分别在0.5~0.9和1.6~3.0 ng/mL范围内.
| Table 2 Linear regression and LOD, LOQ date of polyamines from plant samples |
方法的重现性通过日内和日间精密度评价. 日内和日间相对标准偏差的计算是通过测量3种不同浓度(20, 100和500 ng/mL)目标物. 1 d平行测定3次得到日内相对标准偏差, 连续测定3 d得到日间相对标准偏差. 如表3所示, 目标物日内和日间精密度分别低于6.8%和12.0%; 此外, 3种不同浓度(20, 100和500 ng/mL)多胺在空白植物样品中的相对回收率范围为87.5%~111.3%(见表4). 以上结果表明, 该方法具有良好的重现性和准确性, 可用于植物样品中多胺的检测.
| Table 3 Method reproducibility assessed by intra- and inter-day precisions at three different concentrations of polyamines in spiked plant samples |
| Table 4 Method recoveries of polyamines at three different concentrations from spiked plant samples |
本文提出的In syringe dSPE-UHPLC-MS/MS方法与文献[26, 27, 28, 29, 30]报道的测定植物样品中多胺的方法相比, 它们检出限相当, 但本文方法前处理时间更短, 提高了前处理过程效率(见本文支持信息表S1). 此外, 本文方法仅消耗少量有机溶剂, 表现出较高的回收率及较宽的线性范围, 可用于植物样品中多胺的定量分析.
采取本文方法对空白拟南芥叶样品中的CAD和PUT进行测定, 在该植物样品中检测到了PUT(47.1± 5.8) μ g/g. 图5为萃取后CAD和PUT的色谱图, 目标物的色谱峰不存在其它杂质干扰, 表明SiW11/SiO2纳米纤维对植物样品中多胺具有良好的萃取效果.
采用静电纺丝技术制备了尺寸均一的SiW11掺杂的纳米纤维材料(SiW11/SiO2), 与未添加SiW11的SiO2纳米纤维相比, 该材料具有强阳离子交换作用, 将该材料以Insyringe dSPE萃取模式应用于拟南芥叶中尸胺和腐胺2种多胺的萃取分析研究, 建立了Insyringe dSPE-UHPLC-MS/MS检测拟南芥叶中尸胺和腐胺的分析方法. 所建立的方法在10~1000 ng/mL范围内具有良好的线性, R2≥ 0.9950; 加标回收率在87.5%~111.3%之间, RSD< 7.2%, 具有良好的准确度和重现性. 采用静电纺丝技术制备SiW11/SiO2避免了以往POM修饰改性过程的制备繁琐、 固载量少的问题, 其成本廉价、 反应温和且可实现大量制备. 此外, POM种类多样, 可通过分子裁剪组装进行多重修饰; 结合静电纺丝技术, 有望实现不同种类POM掺杂纳米纤维的制备并应用于分析领域.
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/cjcu20180531.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|