联系人简介: 唐黎明, 男, 博士, 教授, 博士生导师, 主要从事高分子化学方面的研究. E-mail: tanglm@tsinghua.edu.cn
利用阿维菌素具有的2个活性羟基, 连续与丙烯酰氯、 四乙烯五胺和琥珀酸酐反应, 制备了带有酯键并对药物亲和的乳化剂前体; 并采用多种技术表征了其结构. 该乳化剂前体经中和后, 可以与阿维菌素在水中自发形成稳定的纳米农药乳液, 纳米乳液的粒径可以通过改变乳液载药量或乳化剂中和程度来调节. 该纳米乳液显示出一系列优良性能, 包括高载药量、 高稳定性、 耐光解、 低表面张力和高的叶面亲和性. 在酯酶存在或强碱性条件下, 乳化剂的酯键发生水解, 致使乳化剂亲水部分与亲油部分分离, 从而促进阿维菌素从颗粒中的释放, 故该纳米农药具有比市售阿维菌素乳油更好的杀虫效果.
Based on the two active hydroxyl groups, avermectin reacted with acryloyl chloride, tetraethylenepentamine and succinic anhydride consecutively to obtain a new kind of emulsifier precursor with ester bonds and drug affinity. The structure of the emulsifier precursor was characterized by various techniques. After neutralization, the emulsifier and avermectin could form a stable nanoemulsion in water spontaneously. The particle size of the nanoemulsion could be adjusted by drug loading and neutralization extent. The nanoemulsion exhibited a series of good properties, including high drug loading, high stability, photolysis resistance, low surface tension and high leaf affinity. The ester bonds in the emulsifier could be hydrolyzed in presence of esterase or under strong alkaline, so that the hydrophilic part of the emulsifier could be separated from the lipophilic part, promoting the releasing of avermectin from the particles. Therefore, this nano pesticide exhibited a better insecticidal effect than the commercial avermectin emulsifiable concentrate(EC).
农药具有高效经济的特点, 在防御生物灾害、 保障粮食生产和促进农产品产量增长等方面起到了重要作用[1]. 但传统的农药剂型(如乳油及可湿性粉剂等)含有较多的有机溶剂和添加剂, 存在颗粒粗大和水分散性差等缺点, 使其生物活性较低、 降解缓慢, 导致农药的利用率极低(< 0.1%), 并会带来诸多环境问题[2]. 近年来, 结合纳米技术的新型农药受到极大关注[3, 4, 5], 已开发出包括纳米微乳液、 纳米胶囊和纳米悬浮液等多种剂型的纳米农药[6, 7, 8, 9, 10]. 纳米农药以纳米材料吸附或包裹农药分子, 可以提高农药在水中的分散性和稳定性, 促进农药对叶片表面的黏附, 并控制农药的释放, 从而提高其生物活性[11]. 目前, 在纳米农药控制释放方面也取得了一定的进展[12, 13, 14, 15, 16, 17]. 阿维菌素是一种应用广泛的农药, 但极低的水溶性(约7.8 μ g/mL)及较弱的光稳定性严重限制了其应用[18].
本文通过阿维菌素连续与丙烯酰氯、 四乙烯五胺和丁二酸酐反应, 得到一种具有酯键并可以亲和阿维菌素分子的乳化剂前体, 经过中和得到乳化剂. 该乳化剂在水中可以与阿维菌素自发形成稳定的纳米乳液, 该乳液体系表现出一系列优良性能, 包括高载药量、 高稳定性、 抗光解、 低表面张力、 高叶面亲和性和可控释放特性. 在强碱性或酯酶存在的条件下, 乳化剂中的酯键断裂, 使得亲水部分与亲油部分分离, 从而促进包裹的阿维菌素释放, 并因此提高了杀虫效果.
阿维菌素B1a(纯度95%, MYM生物技术有限公司); 丙烯酰氯(分析纯, 阿拉丁生物技术有限公司); 二氯甲烷和二甲基亚砜(分析纯, 北京化工厂); 4-二甲氨基吡啶、 丁二酸酐、 四乙烯五胺、 三乙胺、 三乙醇胺和磷钨酸(分析纯, 上海麦克林生物技术有限公司); 酯酶(来源自大肠杆菌, Sigma-aldrich公司); 阿维菌素乳油(质量分数5%, 河北威远化学有限公司).
X-4型显微熔点测试仪(北京泰克仪器有限公司); Nicolet 560型傅里叶变换红外光谱(美国尼高力仪器公司); JNM-ECA 600型核磁共振波谱仪(日本电子株式会社); Vario EL Ⅲ 型元素分析仪(德国Elementar公司); Zetasizer 3000HS型粒径测试仪(英国马尔文仪器公司); Hitachi H600型透射电镜(日本株式会社日立制作所); HZ800型表面张力仪(淄博渤海仪器公司); UV-3200型紫外-可见分光光度计(上海美谱达仪器公司).
先将阿维菌素(5 mmol, 4.4 g)和过量的丙烯酰氯(20 mmol, 1.8 g)溶解于50 mL四氢呋喃中, 向其中加入三乙胺(15 mmol, 1.5 g), 将该溶液倒入置于冰水浴中的单口烧瓶中, 在冰水浴下逐滴加入丙烯酰氯溶液, 反应4 h后, 过滤, 旋转蒸发除去溶剂. 将得到的固体溶解于二氯甲烷中, 用0.1 mol/L碳酸钠溶液洗涤、 分液, 经真空干燥, 得到丙烯酰化阿维菌素.
将丙烯酰化阿维菌素(1.5 g)与四乙烯五胺(3 mmol, 0.6 g)混合溶解于30 mL二甲基亚砜中, 在40 ℃下反应6 h, 再加入过量的丁二酸酐(15 mmol, 1.5 g)、 4-二甲氨基吡啶(1.5 mmol, 0.18 g)和三乙胺(15 mmol, 1.5 g), 继续反应2 h, 得到乳化剂前体溶液.
将乳化剂前体溶液滴入水中, 得到其水分散液, 置于截留分子量为1000的透析袋中透析24 h, 将透析袋中的分散液真空干燥, 得到棕黄色固体粉末, 即为阿维菌素乳化剂前体. 分别测试了产物的红外光谱、 核磁共振波谱及元素含量.
向乳化剂前体溶液中加入一定量的三乙醇胺用于中和羧基, 再向溶液中加入一定量的阿维菌素, 搅拌溶解. 在磁力搅拌(600 r/min)下将阿维菌素溶液逐滴加入到水中, 继续搅拌30 min使其分散均匀稳定. 将得到的纳米乳液置于截留分子量为1000的透析袋中, 在去离子水中透析12 h以除去杂质. 将得到的纳米乳液转移至烧杯中, 添加去离子水使总质量达到30 g, 得到淡黄色的阿维菌素纳米乳液.
使用激光粒度仪测定纳米乳液中粒子的粒径. 使用透射电镜观察纳米乳液中颗粒的形貌. 将纳米乳液稀释100倍后滴在铜网上, 使用质量分数为2%的磷钨酸溶液染色并干燥; 置于透射电子显微镜(TEM)下观察, 电压为80 kV. 通过对10个不同区域的粒子进行粒径统计, 得到粒径分布图.
采用2种方法评价了纳米乳液的稳定性. 一种是稀释稳定性, 即将纳米乳液用去离子水稀释后, 采用动态光散射法测定稀释前后的乳液粒径. 另一种是离心稳定性, 即在离心管中加入纳米乳液, 在10000 r/min转速下离心, 采用动态光散射法测定离心不同时间后乳液的粒径及其分布.
在不同的培养皿中分别加入一定量的阿维菌素乙醇溶液和阿维菌素纳米乳液. 将干燥后的培养皿置于紫外灯(1000 W)下照射不同时间, 然后加入定量的乙醇溶解照射后的样品, 用紫外-可见分光光度计测试溶液的吸光度, 并通过标准曲线计算剩余阿维菌素的质量.
将乳化剂前体配制成水溶液并中和, 测试不同浓度溶液的表面张力并绘制成曲线, 得到乳化剂的临界胶束浓度及纳米乳液的表面张力.
将植物叶片切成片, 并测量叶片的面积S(cm2). 用镊子将叶片浸入烧杯内的纳米乳液中保持15 s, 然后将叶片移出并悬在烧杯上方直到无液滴滴落, 将叶片放在一边. 将镊子放回烧杯中, 称量烧杯减少的质量, 即为黏附在叶片上的液体质量m(mg). 叶片残留率按照m/S(mg· cm-2)计算[19].
使用接触角测量仪测量纳米乳液在黄瓜和甘蓝叶片上的接触角. 将新鲜的植物叶片固定在洁净的载玻片上, 将载玻片放在操作台上, 用注射器将一滴纳米乳液滴在叶子的平坦表面上, 30 s后用电荷耦合图像传感器照相机拍摄叶片上的液滴, 并通过五点拟合分析法计算液滴在叶片上的接触角.
采用透析法测试阿维菌素乳液的缓释性能[20]. 缓释介质为去离子水/乙醇混合液(质量比为7∶ 1), 温度为室温, 缓释pH分别为8, 12和8(加入酯酶). 同时, 测试市售阿维菌素乳油及阿维菌素乙醇溶液在中性条件下的缓释曲线作为对照.
参照联合国粮食及农业组织(FAO)推荐的蚜虫喷雾法, 及NY/T 1154.9-2008《农药室内生物测定准则杀虫剂第9部分: 喷雾法》进行生物活性测试[21]. 活性测试喷雾体积为3 mL, 喷雾压力100 kPa, 沉降时间30 s. 实验温度(25± 2) ℃, 湿度(75± 5)%, 光暗比16∶ 8, 作用48 h后通过解剖显微镜对死亡和存活的蚜虫进行计数. 使用DPS v12.01统计软件计算毒性回归方程、 相关系数、 半数致死浓度(LC50)和95%置信区间.
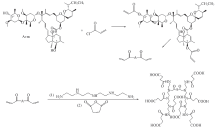
为了实现对阿维菌素的高效分散和包裹, 从阿维菌素分子出发设计并制备了一种含有酯键的乳化剂前体. 首先, 通过阿维菌素与丙烯酰氯反应制备丙烯酰化阿维菌素, 丙烯酰化阿维菌素进一步与四乙烯五胺和丁二酸酐反应, 得到该乳化剂前体, 合成过程如Scheme 1所示. 虽然阿维菌素有3个羟基, 但C7处的羟基因过大的位阻效应而难于改性, 仅有C4″和C5处的羟基可以参加反应[22]. 乳化剂前体分子的亲油部分为阿维菌素结构单元, 可以亲和阿维菌素分子, 而外围大量的羧基基团可以在中和后提供亲水性, 亲水和亲油部分以酯键连接在一起, 酯键断裂导致两部分分离, 乳化剂失去两亲性, 从而促使包裹的阿维菌素析出.
通过比较丙烯酰化阿维菌素与阿维菌素的红外谱图(图S1, 见本文支持信息)发现, 1730 cm-1处丙烯酸酯基的羰基振动峰的增加和890 cm-1处的双键峰的出现证明丙烯酰氯改性成功. 乳化剂前体的红外谱图(图S1)在2500~3300 cm-1处出现了宽而散的峰, 为羧基氢键二聚体中的羟基的伸缩振动峰; 1400和1250 cm-1处的峰为羟基的弯曲振动和C— O键伸缩振动偶合的结果; 1750 cm-1处为酯键和羧基中羰基的特征峰, 均证明其中羧基的存在; 而1637, 1561和1457 cm-1处的峰分别归属于酰胺中羰基的伸缩振动、 酰胺二带以及N— H的弯曲振动, 表明其中含有酰胺基团. 另外, 890 cm-1处双键的峰高显著降低, 表明双键参与了加成反应.
丙烯酰化阿维菌素的核磁共振谱图(图S2, 见本文支持信息)与纯阿维菌素分子(图S3, 见本文支持信息)相比, 含有δ 5.0, 4.0和3.1等相同的核磁峰; 而δ 5.9, 6.1和6.3处的3个峰为丙烯酸酯基双键上3个氢的峰, δ 4.8为与酯键相连的氢峰, 证明丙烯酸酯改性成功. 乳化剂前体的核磁共振谱图(图S4, 见本文支持信息)在δ 12.0处出现了羧酸基团的氢峰, 在δ 7.9处出现了酰胺基的氢峰, 证明了产物的结构. 表1列出了阿维菌素、 丙烯酰化阿维菌素及乳化剂前体的元素分析结果, 可见丙烯酰化阿维菌素的C, H, O含量与理论预测值基本一致. 由乳化剂前体的元素分析结果可知, N含量从原本的0.1%提高到5%, 说明四乙烯五胺与丙烯酰化阿维菌素发生加成反应, 由于加成并不完全, 乳化剂前体的N含量处于单加成与双加成产物之间, 表明乳化剂中同时含有单加成和双加成产物.
| Table1 Elemental analysis results of acrylated avermectin and emulsifier precursor |
将阿维菌素溶解于中和后的乳化剂溶液中, 搅拌下将溶液滴入水中, 由于乳化剂的作用, 形成了稳定的阿维菌素纳米乳液. 表2示出了不同载药量(阿维菌素质量与乳化剂和阿维菌素总质量的比值)以及不同中和比(乳化剂与三乙醇胺的摩尔比)对于纳米乳液的粒径和聚合物分散性指数(PDI)的影响. 可见, 当乳化剂与三乙醇胺的摩尔比为1∶ 8时, 得到的纳米乳液的平均粒径较大(176 nm), 这可能是由于中和不充分所致. 随着三乙醇胺用量的增加, 当摩尔比达到1∶ 12时, 平均粒径已经小于100 nm, PDI值也明显减小. 另外, 随着载药量的逐渐增大, 乳液的平均粒径和PDI值也逐渐增大, 这是由于乳液中的每个纳米粒子中包裹了更多的疏水阿维菌素分子. 当载药量≤ 50%时, 乳液粒径均较小, 乳液可以长期稳定放置. 在后续研究中采用样品4作为研究对象.
| Table 2 Formulation and particle size of the nanoemulsion |
图1(A)为纳米乳液中纳米粒子的透射电子显微镜(TEM)照片, 可见, 纳米粒子呈较整齐均匀的球形. 图1(B)示出了统计后纳米粒子的粒径及分布, 可见, 其粒径主要分布在60~110 nm范围内, 平均粒径为84 nm, 比通过动态光散射测得的粒径(96 nm)偏小, 这其是由于干态下纳米粒子收缩所致.
基于农药的实际使用情况, 实验测试了纳米乳液的稀释稳定性、 离心稳定性以及放置稳定性. 根据目前商用阿维菌素乳液的使用稀释标准, 测试了纳米乳液在稀释100倍和1500倍条件下的稳定性(图S5, 见本文支持信息). 可见, 稀释后乳液依然保持澄清状态, 未出现沉淀, 粒径略有减小, 证明乳液在稀释后仍保持稳定状态. 纳米乳液在室温下静置90 d仍保持较澄清的外观, 并未出现沉淀, 粒径也基本不变, 证明了乳液在室温下的稳定性.
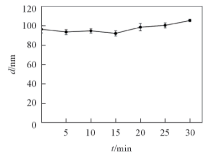
在经过高速离心后, 乳液的外观与透明性基本未改变. 图2为离心时间与乳液粒径的关系图, 可见, 经过高速离心较长时间后乳液粒径依然保持在约100 nm, 说明该乳液具有优良的剪切稳定性.
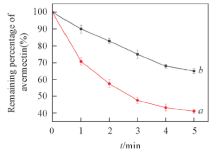
阿维菌素是一种易于光分解的农药[23], 从而限制了其广泛应用. 实验考察了不同紫外光照射时间下纯阿维菌素和纳米乳液中阿维菌素含量的变化. 由图3可见, 纯阿维菌素的光降解速度明显快于乳化剂包裹的阿维菌素. 这可能是由于乳化剂分子具有阿维菌素结构单元, 其本身可以吸收紫外光[14], 从而提高了包裹阿维菌素的抗光解能力.
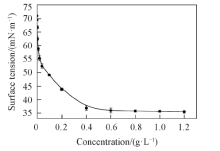
低的表面张力有利于农药在作物叶面上的铺展和润湿, 有助于防止液滴从叶面的滑落和损失. 图4示出了乳化剂水溶液的表面张力随浓度变化曲线,
是典型的表面活性剂的表面张力曲线[24]. 当溶液中不含乳化剂时(纯水), 在25 ℃下表面张力为71 mN/m; 在低浓度区间, 溶液表面张力随着浓度的增加而显著降低; 在高浓度区间, 溶液表面张力曲线出现1个约为35.2 mN/m的平台区. 这2部分的转折点即为乳化剂的临界胶束浓度, 约为0.4 g/L, 而平台区为超过临界胶束浓度的溶液的表面张力, 即纳米乳液的表面张力. 阿维菌素纳米乳液的表面张力可以降至35.2 mN/m, 有利于其在较低表面张力的叶片上铺展. 经过测试发现, 纳米乳液在黄瓜及甘蓝叶片上的接触角分别为43.5° 和51.5° , 明显小于去离子水的接触角(71.9° 和97° ), 表明该乳液有比较好的铺展性能.
在使用过程中, 农药首先沉积在作物叶片上, 再转移到其它部位并发挥功效. 在叶片上的高黏附性有助于减少药物损失并提高药效. 表3列出了阿维菌素纳米乳液在疏水的水稻和甘蓝及亲水的黄瓜叶片上的残留量, 分别为去离子水的7.8, 2.2及1.6倍, 是市售阿维菌素乳油的2, 1.6及1.5倍, 表明纳米乳液对亲水和疏水的叶片均有较强的黏附性能, 这可归因于纳米乳液自身较低的表面张力.
| Table 3 Retention of avermectin nanoemulsion, deionized water and avermectin EC on leaves |
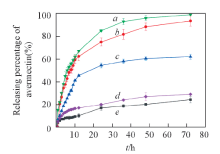
测定了纳米乳液在中性、 强碱性及含有酯酶的释放介质中的释放行为, 并测定对照组在中性条件下的释放行为, 结果如图5所示. 纯阿维菌素的释放依靠扩散作用,
所以最快; 而中性条件下阿维菌素纳米乳液和市售阿维菌素乳油的释放速率均比较慢, 表明纳米乳液具有稳定的缓释效果, 有助于延长农药的持效时间. 与中性条件相比, 在强碱性或是含有酯酶的释放介质中, 纳米乳液的释放明显加速, 可以快速将其中包裹的阿维菌素分子释放出来. 其原因是在强碱性或存在酯酶的条件下, 乳化剂中的酯键发生断裂[25], 使乳化剂的亲水部分和亲油部分分离, 从而失去两亲性, 由于纳米粒子表面的电荷排斥作用下降, 导致其在水中的稳定性下降, 从而发生聚集并沉降出来, 促使阿维菌素快速释放出来. 由于生物体内含有酯酶, 一旦纳米颗粒进入虫子体内, 在酯酶的作用下, 纳米颗粒中的阿维菌素可以快速释放并起到高效的杀虫作用[26].
纳米农药的可控释放性能对其药效有明显影响, 如果纳米农药粒子能在目标虫的体内快速释放农药, 就可以提高其杀虫效果. 利用蚜虫喷雾法测定了阿维菌素纳米乳液样品的毒性, 同时测定了乳化剂本身及市售阿维菌素乳油的毒性, 结果列于表4, 毒性大小用LC50值表示[27]. 可见, 阿维菌素纳米乳液的LC50值为36.18 μ g/mL, 低于市售阿维菌素乳油的LC50(38.20 μ g/mL), 表明其药效高于乳油. 另外, 纯乳化剂本身基本无毒性, 说明纳米乳液的毒性主要来自于其中包裹的阿维菌素分子.
| Table 4 Toxicity test results of nanoemulsion and commercial EC |
制备了一种以酯键连接, 亲和阿维菌素的乳化剂前体, 进一步制备出阿维菌素纳米乳液. 纳米乳液中的纳米颗粒呈球型, 粒径大小可控. 该纳米乳液具有高的载药量、 良好的稳定性、 较强的叶片黏附能力及抗光解能力等优良性能. 在一定条件下, 乳化剂中的酯键水解断裂并失去两亲性, 从而使乳液中纳米粒子失去稳定性并促使其中包裹的阿维菌素释放出来. 由于生物体内的酯酶可以起到水解酯键的作用, 这种纳米农药具有优于市售阿维菌素乳油的毒性.
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/cjcu20180702.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|