联系人简介: 颜世峰, 男, 博士, 教授, 主要从事生物医用高分子材料研究. E-mail: yansf@staff.shu.edu.cn;尹静波, 女, 博士, 教授, 主要从事生物医用高分子材料研究. E-mail: jbyin@oa.shu.edu.cn
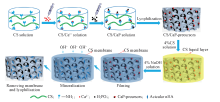
通过原位沉淀法和冷冻相分离技术得到含有钙磷前驱体(CaP)的初始多孔支架, 利用多孔支架表面原位生成的壳聚糖(CS)膜减缓NaOH溶液中OH-离子的渗透速率, 以达到纳米羟基磷灰石(nHA)缓慢形成的目的, 从而制得nHA 分布均匀的CS/nHA多孔复合支架. 利用扫描电镜(SEM)和万能试验机研究复合支架的结构和性能, 发现nHA为针状结构, 长度为80200 nm, 宽度为2050 nm. 随着nHA含量的增加, 复合支架的孔隙率下降, 由(93.8±3.3)%降至(87.7±3.8)%, 压缩强度则逐渐提高, 由(0.5±0.09) MPa增加至(1.5±0.06) MPa. 当复合支架中nHA质量分数为25%时, 未发现nHA团聚现象, nHA均匀地分布于CS基体中. 通过红外光谱(FTIR)、 X射线衍射(XRD)及X射线光电子能谱(XPS)等分析推断, nHA与CS之间可能存在配位和氢键作用. 细胞实验结果表明, CS/nHA多孔复合支架具有良好的生物相容性, 细胞在支架内部贴壁黏附生长. CS/nHA多孔复合支架有望在骨组织工程领域具有良好的应用前景.
The initial porous scaffold containing calcium phosphate precursors(CaP) was obtained by in situ precipitation and freezing phase separation techniques. The chitosan(CS) membranes generated in situ on the outer layer of porous scaffolds were used to slow down the penetration rate of OH- ions in NaOH solution, so as to achieve the purpose of slow formation of nano-hydroxyapatite(nHA), and thus to prepare CS/nHA porous composite scaffolds with uniform distribution of nHA. The scanning electron microscopy(SEM) and universal testing machine were used to study the structure and properties of the composite scaffold. It was found that the nHA was acicular structure, with a length of 80―200 nm and a width of 20―50 nm. With the increase of nHA content, the porosity of the composite scaffold decreased from (93.8±3.3)% to (87.7±3.8)%, and the compressive strength gradually increased from (0.5±0.09) MPa to (1.5±0.06) MPa. No obvious agglomeration of nHA was found, and nHA was evenly distributed in the CS matrix when the content of nHA in the composite scaffold was 25%. It is concluded by infrared spectrometer(FTIR), X-ray diffractometer(XRD) and X-ray photoelectron spectrometer(XPS) analysis that there may be coordination and hydrogen bonding between nHA and CS. The results of cell experiments showed that the nHA/CS porous composite scaffold has good biocompatibility, and the cells adhered to the scaffold. It is expected that the CS/nHA porous composite scaffold has a good application prospect in the field of bone tissue engineering.
近年来, 利用生物仿生思路进行设计骨组织工程支架引起人们的广泛关注[1, 2]. 骨主要是由钙磷盐和胶原组成, 其中钙磷盐的主要存在形式为纳米羟基磷灰石(nHA). nHA具有良好的生物相容性、 骨传导性、 无免疫原性和骨整合特性[3, 4, 5, 6]. 然而, 由于nHA固有的脆性和硬度使其很难被加工成骨替换材料. 将nHA与高分子复合制备有机-无机杂化材料可有效解决上述问题[7, 8]. 壳聚糖(CS)作为一种天然高分子, 具有良好的生物相容性和生物降解性, 被广泛用于生物医学工程领域. 将nHA和CS结合构建多孔复合支架可以弥补单一材料性能的不足, 使其更好地应用于骨组织工程领域[9, 10, 11, 12].
目前制备的CS/nHA多孔复合支架存在2个普遍问题: (1) nHA在复合支架中分散性较差; (2) nHA与CS基体材料之间的结合力较弱. 复合支架中的nHA分布不均匀不利于细胞在支架上黏附和迁移以及支架与骨缺损部位的骨整合, 同时也会影响复合支架的孔隙结构, 降低支架的机械性能[13, 14, 15, 16, 17, 18]. 而nHA与CS基体之间的结合力弱则无法保证复合支架在植入体内后的稳定性, 从而导致nHA脱离支架并随体液流动侵入正常组织[19, 20, 21], 这些问题在很大程度上降低了复合支架的骨修复效果. 为了解决这些问题, 研究人员提出诸多解决方案[22], 包括溶胶-凝胶法、 共沉淀法及原位沉淀法等[23, 24, 25], 其中, 原位沉淀法由于自身优势成为制备CS/nHA复合支架的常用方法. 其原理是通过高分子的官能团(如氨基, 羧基等)与无机离子(如钙离子等)间的配位作用使其结合, 然后通过调节溶液pH值, 从而在结合点处生成nHA, 该方法有效增强了nHA与高分子基体的结合力. Zhang等[26]利用原位沉淀法制备出具有类骨结构的CS/nHA复合支架, 但当nHA的质量分数超过15%时, 制得的复合支架中会出现明显的nHA团聚现象.
针对上述问题, 本文通过原位沉淀法和冷冻相分离技术得到含有钙磷前驱体(CaP)的初始多孔支架, 在多孔支架外层原位生成CS薄膜, 利用CS膜减缓NaOH溶液中OH-离子渗透速率, 从而缓慢地生成针状nHA, 旨在获得较高含量nHA且均匀分散的CS/nHA复合支架. 研究了CS/nHA复合支架的组成、 结构、 力学性能以及细胞在复合支架上的黏附与增殖行为, 为CS/nHA复合支架在骨组织工程中的应用奠定基础.
壳聚糖(Mw=4× 104~5× 104, 脱乙酰度为 95%, 济南海得贝生物工程有限公司); 无水氯化钙、 二水合磷酸二氢钠和乙酸(分析纯, 上海国药集团); MTT检测试剂盒(Servicebio公司); Calcein-AM/PI 活细胞/死细胞双染色试剂盒、 TPITC Phalloidin和Hoechst 33258染液(上海翊圣生物科技有限公司).
SU-1500型钨灯丝扫描电子显微镜(日本HITACHI公司); Apollo-300型热场发射扫描电子显微镜(英国Cambridge公司); FTIR-380型红外光谱仪(美国Thermo公司); ESCALAB 250Xi型X射线光电子能谱仪(美国Thermo公司); D/MAX2500型X射线衍射仪(日本理学公司); 荧光显微镜(LEICA公司); Q500型热重分析仪(美国TA公司); LSM710型共聚焦显微镜(德国Zeiss公司); VDXLL-10000 型万能电子拉力机(上海德杰仪器有限公司).
1.2.1 CS支架的制备 将1.2 g CS粉末溶于30 mL体积分数为3%的醋酸溶液中, 将CS溶液倒入模具中, 冻干. 将冻干后的支架浸泡于质量分数为4%的NaOH溶液中, 24 h后取出, 用去离子水反复洗涤以除去残留的NaOH及乙醇, 再次冻干得到CS支架.
1.2.2 CS/nHA支架的制备 将1.2 g CS粉末溶于22 mL 3%的醋酸溶液中, 然后在搅拌条件下向CS溶液中逐滴加入5 mL CaCl2(0.157 mol/L)溶液, 搅拌4 h后, 再逐滴加入3 mL NaH2PO4· 2H2O(0.157 mol/L)溶液, 搅拌4 h后, 将此溶液倒入模具中并超声30 min, 静置4 h后冻干制得初始多孔支架. 将所得支架置于质量分数为4%的CS溶液中, 浸润10 min后转移至NaOH溶液中, 浸泡24 h后取出支架, 切除外层CS膜后用去离子水反复洗涤至NaOH无残留, 再次冻干后得到CS/nHA复合支架. 通过改变所加CaCl2和NaH2PO4· 2H2O的浓度制得nHA质量分数为5%, 15%, 25%和35%的支架, 分别命名为CS/nHA5, CS/nHA15, CS/nHA25和CS/nHA35.
参照文献[20]采用乙醇法测定支架的孔隙率. 样品支架本身的体积Vs=(m1-m2+ms)/ρ ; 样品支架孔体积Vp=(m2-m3-ms)/ρ ; 孔隙率Vp/(Vp+Vs)=(m2-m3-ms)/(m1-m3)× 100%, 式中: m1(g)为装满乙醇的比重瓶质量; ms(g)为支架的质量; m2(g)为将支架浸没于装有乙醇的比重瓶中, 真空脱气后, 再用乙醇填满比重瓶后称得的总质量; m3(g)为支架取出后, 剩余乙醇与比重瓶的质量; ρ (g/mL)为乙醇的密度.
参照文献[27]方法测定支架平衡吸水率. 称量干态下支架的质量md(g), 将支架浸泡在去离子水中24 h, 取出支架并用滤纸擦去表面多余的水, 称量支架质量mA(g). 将浸泡24 h后的支架在500 r/min的转速下离心3 min, 然后测定支架质量mR(g). 平衡吸水率(EA, %)和平衡保水率(ER, %)计算公式如下:
EA=[(mA-md)/md]× 100%
ER=[(mR-md)/md]× 100%
通过万能试验机对干态CS/nHA支架的压缩性能进行表征, 每组5个平行样, 压缩速率为1 mm/min, 最大形变率为50%.
参照文献[28]方法对材料体外溶胀性能进行评估. 将测试样品浸泡在pH=7.4的模拟体液(SBF)中并置于37 ℃摇床中, 通过样品在SBF溶液浸泡不同时间后柱型支架底面直径的改变来表征材料的溶胀行为.
将兔子脂肪干细胞以5× 105 Cell/mL的密度接种到CS/nHA25支架上(3组平行样), 将支架置于37 ℃的含5% CO2培养箱中进行共培养. 于1, 4, 7 d 3个时间点取出样品, 通过Calcein-AM/PI双染法对活细胞和死细胞分别染色并观测结果. 采用MTT法检测细胞增殖情况(对照组和实验组均在96孔板内). 在固定时间点取样, 吸弃培养液, 加入180 μ L培养液和20 μ L MTT工作液, 在培养箱中孵育4 h后, 吸走液体, 加入200 μ L二甲基亚砜(DMSO), 于培养箱中放置15 min后轻轻振荡, 取出100 μ L液体, 用酶标仪检测其在570 nm波长处的吸光度并进行统计学分析[29].
将兔子脂肪干细胞以5× 105 Cell/mL的密度接种到CS/nHA25支架上, 培养7 d后取出样品, 使用Hoechst 33258染液对支架和细胞核进行荧光染色, 使用TPITC Phalloidin染液对细胞骨架(肌动蛋白)进行荧光染色, 然后通过共聚焦显微镜对其进行观察.
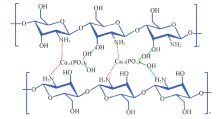
CS/nHA复合支架的制备过程如Scheme 1所示. Ca2+离子可通过配位作用与CS分子上的氨基结合[30].
在静电作用下, H2P
 | Fig.1 Pictures of scaffolds (A) Initial scaffold; (B) CS membrane-covered scaffold; (C) crosssection of CS membrane-covered scaffold; (D) CS/nHA composite scaffold. |
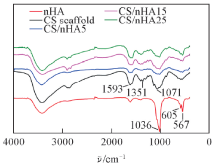
图2为不同nHA含量的复合支架的FTIR谱图. 可见, CS分子中氨基(— NH2)、 酰胺Ⅲ 和仲羟基的特征吸收峰分别位于1593, 1351和1071 cm-1处. nHA分子中P
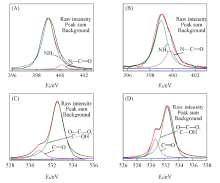
图4为CS支架和CS/nHA25支架中氮和氧的XPS拟合曲线. CS/nHA25支架中
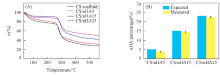
图5为样品的热重分析曲线. 根据投料比, 理论nHA质量分数分别为5%, 15%和25%. 通过热失重测试计算得到复合支架中nHA的实际含量分别为(3.9± 0.3)%, (14.4± 0.5)%和(22.4± 0.4)%. nHA实际含量与理论值较为接近, 表明本文所用制备复合支架的方法具有较高的反应效率.
图6为CS, CS/nHA5, CS/nHA15和CS/nHA25支架的SEM照片. 复合支架呈现均匀贯通的三维多孔结构, 随着nHA含量增加, 复合支架的孔结构没有发生显著变化. 支架的孔径主要分布在200~400 μ m之间, 这是合适的支架孔尺寸分布范围, 有利于细胞生长和所需营养物输送, 也为支架内部血管化和新生骨组织的形成提供了足够的空间[38, 39, 40].
 | Fig.6 SEM images of composite scaffolds (A) CS scaffold; (B) CS/nHA5 scaffold; (C) CS/nHA15 scaffold; (D) CS/nHA25 scaffold. |
图7(A)~(C)显示了CS/nHA25支架上Ca和P元素的分布情况, 表明nHA均匀分散于CS基体中. 图7(D)为CS/nHA25支架的高分辨电镜图和EDS能谱分析结果. 可以发现, 复合支架中的nHA为针状结构, 长度为80~200 nm, 宽度为20~50 nm, 并均匀地分布在支架上或镶嵌于CS基体中. nHA的Ca/P摩尔比为1.64, 这与天然骨中nHA的结构和Ca/P比相接近, 复合支架中类骨nHA的存在有助于材料与骨缺损部位的整合以及材料在体液中的生物矿化[7]. 为了模拟天然骨结构, 在保证支架基本性能的前提下提高nHA分散性和含量成为研究的难点[41, 42]. 本文制备得到CS/nHA复合支架, 当nHA质量分数为25%时, 复合体系中的nHA仍能保持良好的分散性, 高度分散的nHA使复合支架具有极高的比表面积, 为支架细胞和材料间的相互作用提供足够的结合位点[43].
 | Fig.7 SEM image(A), EDS mappings(B, C) and high-magnification SEM image(D) and EDS analysis(inset) of CS/nHA25 scaffold |
为保证营养物和代谢物的高效输送, 骨组织工程支架需要较高的孔隙率, 研究表明支架最佳孔隙率为90%左右[44]. 图8(A)为不同nHA含量的复合支架的孔隙率测试结果. 随着nHA的质量分数从0增加至25%, 复合支架的孔隙率有所下降, 由93.8%± 3.3%降至87.7%± 3.8%. 保水性能是检验骨组织工程支架在体内适应性的常用参数. 如图8(B)所示, 随着nHA含量的增加, 复合支架的吸水率和保水率下降, 当nHA质量分数为25%时, 复合支架的吸水率和保水率达到最低, 分别为(846± 49)%和(611± 37)%, 这是因为nHA的存在减少了自由亲水基团(氨基)的含量, 导致复合支架保水性能下降[45].
在骨组织工程中, 具有足够力学强度的支架能够为种子细胞提供安全稳定的生长环境, 同时, 骨修复早期的自调整也需要支架具有一定的力学强度[46, 47]. 图9(A)为不同nHA含量的复合支架的压缩强度. 当复合支架中nHA含量从0增加到25%时, 复合支架的压缩强度逐渐从(0.5± 0.09) MPa增加至(1.5± 0.06) MPa. nHA可起力学增强作用, 但是当nHA含量较高时, 复合材料的力学性能亦有所下降[48], 实验证明当nHA含量为35%时, 复合支架强度下降. 复合支架的溶胀性能测试如图9(B)所示. 结果表明nHA的增加提高了复合支架尺寸稳定性, 当nHA质量分数为25%时, 复合支架的形变率最小, 为(3.4± 0.7)%.
骨组织工程支架必须对细胞无毒副作用, 综合各组支架性能, 本文选用CS/nHA25支架研究复合支架的生物性能. 在CS/nHA25支架上接种兔子脂肪干细胞, 培养一段时间后通过荧光显微镜对其进行观察. 图10为CS/nHA25支架体外培养细胞1, 4, 7 d后的细胞染色图(绿色表示活细胞, 红色表示死细胞). 结果显示, 在培养过程中没有出现细胞大量死亡现象, 与对照组相比, CS/nHA25支架细胞增殖无明显差异(p> 0.05), 这表明CS/nHA复合支架具有良好的细胞相容性[49].
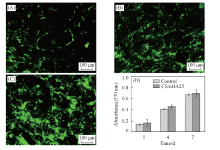 | Fig.10 Live/dead staining images of rASCs cells cultured on CS/nHA25 scaffold for 1 d(A), 4 d(B), 7 d(C) and MTT assay for proliferation(D) |
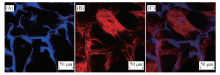
细胞与材料接触后通常要依次经历黏附、 增殖和分化3个阶段, 其中细胞的黏附状态直接影响着细胞随后的增殖和分化, 研究表明细胞贴壁铺展有利于干细胞朝成骨方向分化[50]. 为研究细胞在复合支架上的黏附情况, 本文在CS/nHA25支架上培养细胞, 并对其进行染色观察, 结果如图11所示(荧光照片中蓝色部分为支架和细胞核, 红色部分为细胞肌动蛋白). 肌动蛋白染色是一种经典的表征细胞骨架形态手段, 它能直观地展现和证实细胞的黏附和铺展形态. 由图11可知, 细胞出现大量丝状伪足并黏附于CS/nHA25支架上, 这些典型的形态学特征表明细胞在复合支架上的黏附效果良好, 从而有利于支架上干细胞的成骨分化[51], 为其在骨组织工程中的应用奠定基础.
综上所述, 结合原位沉淀法, 通过CS膜控制纳米羟基磷灰石(nHA)的缓慢生成, 制备出CS/nHA复合支架. 复合支架中的HA为纳米针状结构, 长度为80~200 nm、 宽度为20~50 nm, Ca/P摩尔比为1.64. FTIR, XRD, XPS等研究表明, nHA与CS基体之间存在配位作用, 这使nHA与CS基体紧密结合并均匀分布于支架中. 复合支架的孔径主要分布在200~400 μ m之间, 孔隙率约为90%. 当nHA质量分数为25%时, 复合支架力学性能最佳, 其压缩强度和形变率分别为(1.5± 0.06) MPa和(3.4± 0.7)%. CS/nHA25支架具有良好的细胞相容性且有利于细胞贴壁黏附, 在骨组织工程领域具有一定应用潜力.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|