联系人简介: 李小杰, 男, 博士, 副教授, 主要从事疾病诊断与治疗纳米药物方面的研究. E-mail: xjli@jiangnan.edu.cn
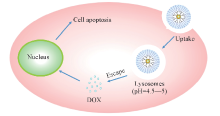
以表面接枝聚乙二醇链的聚酰胺胺树枝状聚合物(PEG-PAMAM)为纳米载体, 在其内部空腔包覆金纳米粒子, 在金纳米粒子表面连接硫辛酸改性的阿霉素(LA-DOX), 从而间接实现了抗癌药物在PEG-PAMAM内的高效负载. 同时, LA-DOX中的酰腙键提供pH响应性, 实现了药物的pH响应性释放. 紫外-可见(UV-Vis)光谱表明, 包覆金纳米粒子的PEG-PAMAM纳米载体对LA-DOX的负载能力显著增强. 体外细胞实验表明, 负载LA-DOX的树枝状聚合物-金纳米粒子复合药物载体具有较强的抗肿瘤能力.
Dendrimer-gold nanoparticle composites were prepared based on poly(ethylene glycol) modified dendrimer(PEG-PAMAM). Gold nanoparticles internal provided an efficient platform for lipoic acid functionalized DoxorubicinLA-DOX linking, leading to the high loading efficiency of anticancer drugs DOX. Meanwhile the hydrazine linker in LA-DOX realized pH sensitive release for nanocarrier. Verified by UV-Vis spectra, the loading efficiency of LA-DOX in dendrimer-gold nanoparticle nanocomposite was improved. Cell Experiment indicated excellent cytotoxicity of dendrimer-gold nanoparticle composite against Hela cells.
纳米科技的发展为肿瘤治疗提供了新手段. 肿瘤组织本身具有特殊的构造和区别于正常细胞的微环境, 使纳米粒子能选择性地富集在肿瘤部位, 从而为肿瘤的靶向给药提供了契机[1~3]. 构建纳米尺寸、 载药量大、 生物毒性低并在肿瘤部位选择性释放药物的药物载体是当今生物医药领域的一个研究热点. 目前, 脂质体、 有机无机杂化纳米颗粒、 聚合物胶束及树枝状聚合物是研究较为广泛的药物载体[2, 3]. 树枝状聚合物因具有独特的分子结构和物理化学性质而备受关注[4]. 树枝状聚合物具有精确的纳米构造, 通常呈现球形或者椭圆形结构, 具有丰富的表面官能团和较大的内部空间, 能包埋并化学键合药物, 在肿瘤诊断及治疗领域具有潜在的应用价值[5]. 通过对树枝状聚合物进行表面改性, 还可以赋予其生物相容性、 单分子稳定性及靶向功能等特性[6, 7, 8, 9, 10, 11, 12]. 表面接枝聚乙二醇链的聚酰胺-胺树枝状聚合物(PEG-PAMAM)具有极低的生物毒性、 良好的单分子稳定性、 长时间血液循环及肿瘤靶向性能[13]. 利用疏水及电荷相互作用, PEG-PAMAM的内腔可以负载抗癌药物分子和光敏剂分子, 特别是含羧基或负电荷的分子[14, 15]. 但由于大多数药物与PAMAM内腔的相互作用力不强, 使PEG-PAMAM中负载的分子在缓冲溶液中会被快速释放, 限制了PEG-PAMAM纳米药物载体在肿瘤治疗中的应用.
树枝状聚合物的内部空腔为纳米粒子提供了吸附位点, 为树枝状纳米载体的构筑提供了新的思路. 树枝状聚合物-金纳米粒子是通过物理相互作用将金纳米粒子(AuNPs)包覆到树枝状聚合物的内部空腔中, 使金纳米粒子表面可以进一步功能化[16]. 因此, 本文以包覆金纳米粒子的PEG-PAMAM(PEG-PAMAM@AuNPs)为纳米载体, 在金纳米粒子表面连接硫辛酸改性的阿霉素(LA-DOX), 制得负载LA-DOX的PEG-PAMAM@AuNPs复合物(PEG-PAMAM@AuNPs-LA-DOX), 实现了抗癌药物在PEG-PAMAM内的高效负载和可控释放. 内核的金纳米粒子显著提高了载体的负载效率[16, 17, 18], LA-DOX中的酰腙键提供了pH响应性[19, 20, 21], 通过体外细胞实验探究了药物载体的抗肿瘤效率.
聚乙二醇(PEG), 数均分子量为2000, 国药集团化学试剂有限公司; 树枝状聚酰胺胺(PAMAM, G4), 数均分子量为14215, 64个氨基基团, Sigma(上海)贸易有限公司; α -硫辛酸(LA), Aladdin生化科技股份有限公司; N, N'-羰基二咪唑(CDI), 国药集团化学试剂有限公司; 盐酸阿霉素(DOX), Aladdin生化科技股份有限公司; 肼基甲酸叔丁酯、 无水乙醚、 无水甲醇及氯仿, 分析纯, 国药集团化学试剂有限公司; 其余试剂或溶剂均为分析纯.
Bruker-DMX500型核磁共振(1H NMR)波谱仪, 德国Bruker公司, 400 MHz; UV-1100型紫外-可见(UV-Vis)分光光度仪, 北京瑞利分析仪器公司; JEM-2100plus型透射电子显微镜(TEM), 日本电子株式会社, 200 kV; Infinite M200Pro型酶标仪, 帝肯奥地利有限责任公司.
1.2.1 PEG-PAMAM@AuNPs的制备 利用对硝基苯基碳酸酯封端的聚乙二醇(PEG-NPC)和PAMAM的酯交换反应制备PEG-PAMAM[22][Scheme 1(A)]. 然后通过原位还原将金纳米粒子负载到树枝状聚合物内核中, 制得PEG-PAMAM@AuNPs[16](Scheme 2).
1.2.2 硫辛酸改性阿霉素(LA-DOX)的制备 将α -硫辛酸(3 g, 14.5 mmol) 和CDI(2.605 g, 16.07 mmol)溶解在10 mL氯仿中, 搅拌活化1 h后, 加入含肼基甲酸叔丁酯(1.874 g, 14.18 mmol)的氯仿溶液10 mL, 在氮气气氛下室温反应12 h; 反应结束后, 用柱层析分离产物(洗脱剂为乙酸乙酯), 最后旋转蒸发除掉溶剂, 得到中间体1(4.04 g, 产率88.99%).
将中间体1(2 g, 6.24 mmol)溶解在10 mL三氟乙酸中, 混合冰水浴反应30 min, 旋转蒸发除掉溶剂, 得到中间体2(1.9 g, 产率90.91%); 将盐酸阿霉素(12 mg, 0.021 mmol)与中间体2(20.75 mg, 0.062 mmol)(体积比为1∶ 3)溶于6 mL无水甲醇中, 室温反应12 h; 用乙酸乙酯沉淀后, 离心分离并真空干燥得到LA-DOX[Scheme 1(B)].
1.2.3 PEG-PAMAM@AuNPs-LA-DOX的制备 将LA-DOX与PEG-PAMAM@AuNPs以摩尔比20∶ 1混合在水溶液中, 搅拌3 h, 透析24 h, 除掉游离的阿霉素分子, 得到PEG-PAMAM@AuNPs-LA-DOX.
1.2.4 体外缓释 将PEG-PAMAM@AuNPs-LA-DOX置于截留分子量为3500的透析袋中, 于37 ℃分别在pH=7.4和5.0的磷酸缓冲液中透析, 每隔一段时间取透析液, 利用紫外-可见分光光度计测试其在最大吸收波长481 nm处的吸光度, 通过吸光度值确定DOX释放量. 每个实验重复3次, 并计算平均值及标准偏差(SD).
1.2.5 体外抗肿瘤性能测定 将Hela 细胞接种于96孔细胞培养板中(每个孔含有大约5000个细胞及100 μ L DMEM培养液), 置于温度为37 ℃, 二氧化碳浓度为5%的培养箱中培养24 h; 加入100 μ L含有不同单分子胶束浓度的培养液, 继续培养48 h; 然后每孔加入20 μ L MTT(5 mg/mL) 的PBS溶液, 再继续培养4 h; 最后, 除去含MTT的培养液后, 加入150 μ L DMSO, 避光摇晃15 min, 使甲瓒溶解完全. 通过酶标仪进行检测, 检测波长为570 nm. 每个实验重复3次, 计算平均值及标准偏差.
为考察载体的生物相容性和单分子稳定性, 利用PEG-NPC与PAMAM的酯交换反应制备PEG-PAMAM[22]. PEG-PAMAM的分子结构通过 1H NMR谱得到验证. 由图1(A)可见, PEG的特征峰— COOCH2CH2O— 与PAMAM的特征峰— NCH2CH2CONH— 的峰面积积分比为128.3∶ 248, 与理论值相符, 证明每个树状聚合物上接枝了约64条聚乙二醇链, PAMAM表面胺基改性率接近100%.
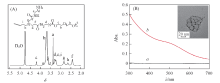 | Fig.1 1H NMR spectrum of PEG-PAMAM in D2O(A) and UV-Vis spectra of PEG-PAMAM(a) and PEG-PAMAM@AuNPs(b) in aqueous solution(B) Inset of (B): TEM image of PEG-PAMAM@AuNPs. |
大多数药物与树枝状聚合物内腔的相互作用力较弱, 为提高载体与药物的相互作用, 通过原位还原将金纳米粒子负载到树枝状聚合物内核中, 制得树枝状聚合物-金纳米粒子复合物[16]. 利用紫外-可见吸收光谱对其进行表征[图1(B)], PEG-PAMAM@AuNPs在520 nm处出现了金纳米粒子的特征吸收峰; 利用TEM表征了PEG-PAMAM@AuNPs的形貌[图1(B)插图], 可见PEG-PAMAM@AuNPs为圆球形, 粒径为6 nm左右, 与之前工作结果一致[23], 证明金纳米粒子负载在PEG-PAMAM内腔.
利用硫辛酸对药物阿霉素进行改性, 改性产物侧链含有二硫五元环基团, 与纳米载体中金纳米粒子具有较强的相互作用[16, 17, 18], 并引入具有pH响应性的酰腙键, 能够在酸性条件下释放出DOX药物分子[19, 20, 21], 从而实现DOX的pH响应性释放.
图2(A)为中间体1的 1H NMR谱图. 五元环上接近S的— CH2与叔丁基的峰面积积分比为2∶ 9, 表明中间体结构和预期一致. 图2(B)为LA-DOX的1H NMR谱图. 接近S的— CH2与— OCH3的峰面积积分比为2∶ 3, 证明LA-DOX被合成.
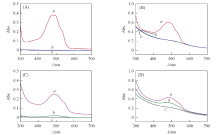
PEG-PAMAM和PEG-PAMAM@AuNPs对原药DOX的负载效率分别如图3(A)和(B)所示. PEG-PAMAM透析后的药物负载效率仅为0.76%, 平均每个树状聚合物中负载0.15个DOX分子, 负载效率极低, 与文献[24]报道基本一致. PEG-PAMAM@AuNPs透析后药物负载率仅为0.95%, 平均每个树状聚合物中负载0.21个DOX分子, 与PEG-PAMAM负载效率相接近, 证明金纳米粒子的引入对未改性的DOX的负载效率基本没有影响, 与预想完全吻合. 这是因为阿霉素与树枝状聚合物之间存在疏水相互作用, 在PBS缓冲溶液中DOX会逐渐负载到树枝状聚合物的内核, 但由于DOX与树枝状聚合物内腔的相互作用力较弱, 药物分子在透析过程中被快速释放, 无法有效延长药物在体内的循环周期.
PEG-PAMAM和PEG-PAMAM@AuNPs对LA-DOX的负载效率分别如图3(C)和(D)所示. PEG-PAMAM透析后对LA-DOX的负载效率为7.98%, 每个树枝状聚合物分子中负载1.59个LA-DOX分子, 负载能力有所增强. 这可能是由于LA-DOX的疏水性比DOX有所增强, 与PEG-PAMAM的疏水内腔的相互作用随之增强. PEG-PAMAM@AuNPs透析后对LA-DOX的负载效率为47.42%, 每个PEG-PAMAM@AuNPs分子中负载9.18个LA-DOX分子, 负载效率显著提高. PEG-PAMAM@AuNPs对LA-DOX的高效负载应归功于LA-DOX与金纳米粒子之间硫-金键的形成, 从而间接实现了DOX在树枝状聚合物中的高效负载.
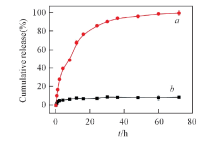
LA-DOX中的酰腙基团提供pH响应性释放功能, 实现药物DOX的响应性释放(Scheme 3). 为研究载药纳米载体的pH响应性, 对PEG-PAMAM@AuNPs-LA-DOX在生理条件下(pH=7.4)和弱酸性条件(pH=5.0)下的药物释放行为进行了研究(图4). 在生理条件下, 72 h时DOX释放量仅为9%, 而在酸性条件下, 72 h时DOX释放量为99%, 证明PEG-PAMAM@AuNPs-LA-DOX能在酸性条件下快速释放负载药物, 具有良好的pH响应性.
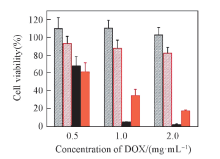
抗肿瘤效率极大地影响纳米载体的应用. 为研究纳米载体的抗肿瘤效率, 分别对PEG-PAMAM@AuNPs、 LA-DOX、 原药DOX和PEG-PAMAM@AuNPs-LA-DOX的细胞存活率进行了研究(图5). 结果表明, 添加不同浓度的PEG-PAMAM@AuNPs, 细胞存活率都较高, 表明纳米载体具有很低的生物毒性. 与原药DOX相比, LA-DOX具有较低的细胞毒性, 这可能是因为药物进入细胞的机制存在一定的差异; 随着DOX浓度的增加, PEG-PAMAM@AuNPs-LA-DOX的细胞存活率相应下降, 证明纳米载体的抗肿瘤能力具有浓度相关性. 载体抗肿瘤效率较高, 有望应用于肿瘤的高效治疗.
本文设计并制备了一种基于表面接枝聚乙二醇链的聚酰胺-胺树枝状聚合物(PEG-PAMAM)的纳米药物载体(PEG-PAMAM@AuNPs-LA-DOX). 该载体具有良好的单分子稳定性及较低的生物毒性, 以金纳米粒子为功能性平台实现了抗肿瘤药物DOX稳定而高效的负载及pH响应性释放性能. 体外细胞实验表明, 负载LA-DOX的树枝状聚合物-金纳米粒子复合物具有较好的抗肿瘤效率, 在生物医学领域具有良好的应用前景.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|




 ), LA-DOX(
), LA-DOX( ), DOX(
), DOX( ) and PEG-PAMAM@AuNPs-LA-DOX(
) and PEG-PAMAM@AuNPs-LA-DOX( ) with gradient DOX concentration
) with gradient DOX concentration