联系人简介: 花修艺, 男, 博士, 教授, 博士生导师, 主要从事环境化学方面的研究. E-mail: huaxy@jlu.edu.cn
通过模拟实验研究了生物膜胞外聚合物(EPS)和乙二胺四乙酸(EDTA) 2种典型溶解有机质(DOM)成分对自然水体生物膜体系中过氧化氢(H2O2)生成特征的影响, 并研究了体系初始pH值、 DOM浓度、 溶解氧(DO)等因素的影响. 结果表明, DOM的存在对自然水体生物膜体系中H2O2的生成有明显影响. 光照能促使EPS产生H2O2, 而EPS的存在对生物膜产生H2O2的直接影响不显著, EPS与生物膜共存体系中的H2O2由二者共同产生; EDTA本身不产生H2O2, 且对H2O2分解影响很小, 但会显著抑制生物膜产生H2O2, 且浓度越高抑制作用越明显. 体系pH值、 DOM浓度和DO均能不同程度影响EPS产生H2O2及EDTA抑制生物膜产生H2O2的作用.
The effects of dissolved organic matter(DOM) on the generation characteristics of hydrogen per-oxide(H2O2) in natural biofilm systems were studied. The biofilm extracellular polymeric substances(EPS) and ethylenediamine tetraacetic acid(EDTA) were chosen as two typical DOM components. The results show that the presence of DOM has significant influences on the generation of H2O2. Illumination can promote EPS to produce H2O2 and EPS has no significant direct influences on generation of H2O2 by biofilms. H2O2 in the coexistence system is produced by both EPS and biofilms. EDTA doesn’t produce H2O2 itself and has little influence on decomposition of H2O2, while showing significantly inhibition correlating to EDTA concentrations positively on the generation of H2O2 by biofilms. The pH value, DOM concentration and dissolved oxygen(DO) of the systems can varyingly affect the generation of H2O2 by EPS and the inhibition of EDTA on the generation of H2O2 in biofilms. Therefore, DOM has influences on both the generation of H2O2 in biofilms and the concentration of H2O2 in water environment, and the influences of different DOM components with different structures and properties may be significantly different.
自然水体生物膜主要是由藻类、 细菌、 微量矿物以及金属(主要为铁、 锰)氧化物等组成的复合生物群落[1], 存在于水环境中的各种固相物质表面, 不仅对周围微环境的特征有显著影响, 而且可以通过吸附、 富集和降解转化等作用影响水中污染物的环境行为[2].
自然水体中存在一定浓度的过氧化氢(H2O2)、 羟基自由基(· OH)、 单线态氧(1O2)等活性氧成分(ROS), 它们具有极强的氧化能力, 是影响有机污染物在水环境中迁移、 转化和生态效应的重要因素[3, 4, 5, 6]. 一般认为水中的ROS主要由光化学过程等非生物过程产生[1]. 近年来有研究表明水中的藻类等生物也可以通过其生命活动产生并释放ROS[7, 8]. 本课题组[1, 2, 9, 10]研究发现, 在可见光照射下的自然水体生物膜/水体系中有机污染物存在显著的降解, 并且这种降解主要与生物膜中藻类的光合作用等生命活动所产生的H2O2等ROS有关.
自然水体中的ROS也可通过溶解有机质(DOM)的光化学反应等非生物作用产生[1, 11, 12]. DOM官能团种类丰富, 是一类结构、 组分复杂的混合有机质, 广泛存在于自然水体中. 在光照条件下DOM可产生· OH和1O2等ROS, 同时DOM自身也能与水中的ROS反应, 并改变其自身的结构和性质[13, 14, 1, 16]. 因此, DOM的存在可能会影响可见光照下的生物膜体系中ROS的生成和存在. 微生物的胞外聚合物(EPS)是一种天然高分子有机物, 主要成分是多糖、 蛋白质等物质, 含有大量的羟基、 羧基和氨基等官能团, 既是自然水体DOM的重要代表性组成成分[17, 18], 也是生物膜的主要组成成分[19]. 另外, 乙二胺四乙酸(EDTA)也经常被作为小分子DOM的代表[20, 21], 用于研究DOM的作用和行为.
目前关于生物膜产生ROS的研究未考虑自然水体中广泛存在的DOM对ROS的影响. 而如前所述, DOM本身会影响ROS的产生和存在, 同时还可能通过与生物膜的作用间接影响生物膜产生ROS. 因此, 为进一步了解DOM和生物膜共存的自然水体中生物膜产生ROS的机制和影响因素, 本文以生物膜产生的EPS和EDTA分别作为高分子和小分子DOM的代表, 以H2O2为ROS的代表, 研究了DOM与生物膜共存的体系中ROS的生消规律, 并定量探讨了初始pH值、 DOM浓度、 溶解氧(DO)等环境参数对共存体系中H2O2生成的影响, 从而有助于更深入地了解自然水体中ROS的生成机制, 以及自然水体生物膜对有机污染物的降解机理.
过氧化氢(分析纯)、 硫酸(优级纯)和氢氧化钠(优级纯), 北京化工厂; 乙二胺四乙酸(分析纯), 天津市大茂化学试剂厂.
光学显微镜(CX21, 奥林巴斯中国有限公司); 原子吸收分光光度计(AA-700, 美国珀金埃尔默公司); 总有机碳分析仪(TOC-VCPH, 配SSM-5000A型固体进样器, 日本岛津公司); 红外光谱仪(IRAffinity-1S, 日本岛津公司); 荧光分光光度计(F-2700, 日本日立高科技公司); 紫外-可见分光光度计(UV1800, 日本岛津公司).
自然水体生物膜在玻璃缸(60 cm× 30 cm× 50 cm)中利用长春市南湖中的水培养, 并在水中加入一定量的微量矿物盐(MMS)溶液[30 mg/L CaCl2· 2H2O+35 mg/L MgSO4· 7H2O+120 mg/L (NH4)2SO4+15 mg/L KNO3+0.84 mg/L NaHCO3+0.7 mg/L KH2PO4][22]. 将洗涤后的载玻片(48 mm× 75 mm× 1 mm)插入聚丙烯架, 在室温和自然光照下培养.
生物膜培养15 d左右, 选取生物膜生长均匀的载玻片, 用MMS溶液润洗后用于实验. 生物膜中主要的微生物种类用光学显微镜观察确定. 生物膜用干重法定量: 将附有生物膜的载玻片在103 ℃干燥至恒重后称重, 刮去生物膜后再次干燥称重, 利用差减法得到生物膜干重. 将附有生物膜的载玻片在25 mL 15%(质量分数) HNO3溶液中持续振荡萃取24 h, 使用原子吸收分光光度计测定萃取液中铁和锰的含量. 使用总有机碳分析仪测定干燥恒重后生物膜的总有机碳(TOC)含量.
溶解态EPS采用高速离心法提取. 刮取载玻片上的生物膜, 加一定量的超纯水制成生物膜悬浊液, 并在4 ℃, 4000g条件下离心20 min, 分离上清液后加水再悬浮, 重复离心3次, 所得上清液用0.45 μ m醋酸纤维滤膜过滤, 冷冻干燥[23], 得到棕色絮状固体, 冷冻保存待用.
将EPS样品与KBr混合研磨并压片, 用红外光谱仪测定EPS的红外光谱. 用荧光分光光度计测定EPS溶液的三维荧光光谱. 用紫外-可见分光光度计扫描EPS溶液的紫外-可见吸收光谱.
1.4.1 模拟实验体系的构建 实验在2 L烧杯中进行, 每个烧杯中加入1.5 L MMS溶液. 自然水体中H2O2的本底浓度一般在nmol/Lμ mol/L范围内[24]. 为了模拟自然水体, 并方便观测体系中H2O2浓度的增减趋势, 将各体系中H2O2初始浓度均设为20 μ mol/L. 采用恒温水浴装置将体系温度控制在(25± 2) ℃, 同时进行连续搅拌. 以稀土补光灯(主要为可见光和红外光)为模拟光源, 置于模拟实验体系上方约1 m处, 使体系水中光照强度为(40000± 3000) Lux. 避光时用锡纸将烧杯包裹, 同时顶部加盖, 此时烧杯中光照强度小于10 Lux. 除研究初始pH值影响的实验体系外, 其余各体系均用4%(质量分数)氢氧化钠和3%(质量分数)硫酸将初始pH值调节为7.0 ± 0.1. 除研究DOM浓度影响的体系外, 其余各加入DOM的体系中, DOM的浓度均为6 mg/L. 在有生物膜的体系中, 每个烧杯中加入装载于聚丙烯架上同批次培养的生物膜6片, 并在加入生物膜的同时开始实验计时. 实验期间监测体系pH值、 温度、 DO等参数的变化, 同时每隔一定时间取样, 用硫酸钛比色法测定H2O2含量[25]. 各实验体系均设置3组平行实验.
1.4.2 DOM与生物膜共存体系中H2O2的生成 实验共设置6组对照实验体系, 分别为H2O2体系(A体系)、 生物膜+H2O2体系(B体系)、 EPS+ H2O2体系(C体系)、 EDTA+ H2O2体系(D体系)、 生物膜+EPS+H2O2体系(E体系)、 生物膜+EDTA+ H2O2体系(F体系). 实验总时长为7.5 h, 前3 h光照, 然后避光3 h, 再重新光照1.5 h. 每隔0.5 h取样, 测定各体系H2O2含量.
1.4.3 影响H2O2浓度的主要因素研究 主要研究pH值、 DOM浓度和DO浓度对H2O2浓度的影响. 各对照实验体系的设置同1.4.2节. 实验进行7.5 h, 持续光照, 每隔1.5 h取样测定H2O2含量. 研究pH值影响时, 各对照体系均设5组初始pH值对照条件, 其初始pH值分别为5.0, 6.0, 7.0, 8.0, 9.0, 各体系以只有H2O2的A体系作为对照, 同时单独DOM体系与生物膜和DOM共存体系进行对照; 研究DOM浓度影响时, 各含DOM的体系(C, D, E, F体系)均设4组DOM浓度对照条件, EPS浓度分别为2, 4, 6, 10 mg/L, EDTA浓度分别为2, 4, 6, 10 μ mol/L, 并与不添加DOM的体系进行对照; 在研究DO浓度的影响时, 各对照实验体系均设1组增氧对照组, 使用空气泵(出气量4 L/min)进行持续曝气增氧(增氧组DO浓度较相应未增氧组增加约2 mg/L).
所培养生物膜的显微镜观察结果表明, 生物膜主要由藻类等微生物和矿物质成分组成, 优势藻种主要为小球藻、 铜绿微囊藻和舟形藻. 生物膜中铁和锰含量分别为(1125± 54.39) μ mol/m2和(997± 32.46) μ mol/m2, 干重为(7.68± 0.24) mg/片, TOC为(0.4185± 0.0161) mg/mg.
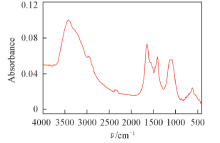
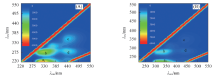
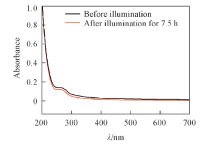
所获取的生物膜EPS的红外(IR)光谱如图1所示. 据图可推断EPS中含有羟基、 亚甲基、 氨基、 羧基、 磷酸根等基团. EPS的三维荧光光谱如图2所示. 从图中可以看出, 该EPS含有4个荧光峰, 其中荧光峰a和b为类蛋白峰, 荧光峰c和d为类腐殖酸峰[26]. 由图中各荧光峰强度可知, 类蛋白质是EPS中主要的荧光物质. 而类蛋白质含有氨基、 羧基等官能团, 与红外光谱表征结果一致. 由图2、 表1及图3可见, EPS在实验后各荧光峰强度及紫外吸收峰强度均有所减弱.
| Table 1 Changes of fluorescence intensity of each fluorescence peak of EPS before and after illumination for 7.5 h |
在光/暗交替条件下各对照实验体系中H2O2的浓度变如图4所示. 其中A和D 2个体系在实验过程中H2O2浓度相近且总体呈持续下降趋势, 并且光照时H2O2浓度下降速率较快而无光照时下降缓慢. 对于B, C, E和F体系, 其H2O2浓度在前3 h的光照阶段均持续上升, 其中E体系浓度上升最快, 其次是B, C与F体系.
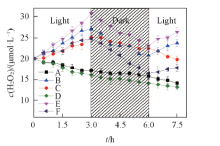 | Fig.4 Generation characteristics of H2O2 in the coexistence systems of DOM and biofilms A— F in the legend represent systems A— F, respectively. |
36 h避光阶段, 各体系H2O2浓度均持续下降, 其中F体系下降幅度最大. 6 h后恢复光照后, C体系H2O2浓度仍逐渐下降, B, E和F体系H2O2浓度均又逐渐上升, 特别是B与E体系.
光照能够促进H2O2的分解[27], 因此A体系在光照条件下H2O2浓度持续下降. 而避光时H2O2分解缓慢, 这与已有研究发现无光时水体中的H2O2浓度会稳定在一个非零值的现象相符[28, 29].
已有研究表明, 生物膜既可以产生H2O2, 又可以分解H2O2, 会显著影响水中H2O2浓度. 生物膜中藻类通过光合作用等生理活动所产生的H2O2等氧化性物质可以排出体外进入水中, 因此生物膜在光照时由于光合作用强烈, 其产生H2O2的作用也最显著, 而无光时H2O2的产生量则较少[7]. 另一方面, 在水中H2O2浓度较高时, 生物膜中的微生物在氧化胁迫下为避免自身的氧化损伤, 又有显著分解H2O2的作用[30]. 因此对B体系, 前3 h光照阶段由于生物膜的光合作用产生H2O2, 且H2O2生成速率远远大于其分解速率, 因此H2O2不断积累. 无光时, 除H2O2的缓慢自然分解外, 生物膜产生H2O2的作用较弱而分解H2O2的作用持续存在, 因此H2O2浓度下降比A体系更快. 恢复光照后, 生物膜的光合作用重新启动, 生成作用大于分解作用, 因此H2O2浓度再次回升.
C体系在前3 h光照时H2O2浓度也持续上升. 研究发现, DOM在光照下能通过2种方式产生H2O2: (1) DOM在光照后可产生水合电子(e)[反应式(1)], 其可与水中的DO反应生成∙
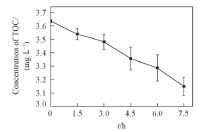
恢复光照后, C体系H2O2浓度没有继续升高反而呈缓慢下降趋势, 这可能是由DOM自身在光照下与水中ROS发生的反应导致. 有研究发现DOM与· OH, 1O2均可反应, 从而被降解, 并导致其结构与性质发生改变[5, 14, 34, 35]. 图2及表1的结果显示, 反应后各荧光峰强度均有不同程度的减弱, 图3的紫外-可见吸收光谱也表明EPS反应后吸光度降低, 由此推测EPS荧光基团随着ROS氧化反应的进行而被破坏[35]. 另外, DOM本身在光照条件下也会发生一系列复杂的光解反应, 生成许多复杂的氧化物和小分子量含碳化合物[36]. C体系中TOC浓度的测定结果表明体系TOC逐渐下降(图6), 说明EPS发生了降解. 这种降解伴随发生的EPS结构和性质的改变以及荧光基团的破坏可能导致其产生ROS的能力显著下降. 另外, DOM也会淬灭体系中的ROS[32, 37], 使ROS浓度下降. 因此恢复光照后体系H2O2浓度并没有升高, 反而有所下降. 所以, EPS在光照下虽能产生一定量的H2O2, 但产生量有限, 且不是一个可持续的过程.
在D体系中, H2O2浓度持续降低且与A体系浓度相近. 可见, 作为小分子DOM代表的EDTA, 由于其结构简单, 本身在光照下不能产生H2O2, 其对H2O2的分解影响也较小.
E体系在光照下由于生物膜与EPS共同产生H2O2, 因此H2O2浓度上升最快. 而E体系与B, C体系叠加后的H2O2产生量相近, 说明EPS对生物膜产生H2O2的协同作用并不明显, EPS没有参与生物膜产生H2O2的过程.
F体系H2O2浓度上升速率明显小于B体系. EDTA作为小分子有机配体, 与金属离子配合能力较强. 生物膜中存在的铁、 锰氧化物及其释放的铁、 锰离子可被生物膜吸收利用, 参与到其光合作用和呼吸作用等新陈代谢过程中[2], 从整体上提高生物活性[34], 进而促进H2O2的生成. 加入体系的EDTA会与这些金属形成配合物, 从而在一定程度上抑制生物膜产生H2O2. 另一方面, EDTA与Fe3+形成的配合物(FeⅢ · EDTA)-能够直接催化分解H2
2.3.1 初始pH值的影响 不同pH值条件下各体系H2O2浓度的变化情况如图7所示. 由图7(A)可见, 在酸性和中性条件下H2O2分解量较少, 碱性条件下分解量较多, 与其基本性质一致[27]. 由图7(B)可见, pH=7的体系中H2O2产生量最多, 说明接近中性的条件更适宜生物膜中藻类的生长, 且酸性体系H2O2产生量大于碱性体系, 这与已有研究中报道的酸性及中性条件下生物膜的生长代谢较旺盛, H2O2产生量高于碱性条件相符[1, 9].
由图7(C)可见, 在不同pH值下, C体系中H2O2浓度变化均与图4类似, 再次证明EPS产生H2O2的不可持续性. 其中pH=6时H2O2产生量最高, 其次是pH值为7和5的体系, 碱性条件下H2O2产生量最低. 根据反应式(2)和(3)可知, 酸性条件有利于H2O2的生成, 而pH值过低时, H+会大量占据EPS官能团的配位点[39], 抑制反应(1)的进行, 从而不利于∙
图7(E)显示, E体系H2O2浓度持续上升, 特别是前3 h, 之后上升速率较慢, E体系H2O2浓度变化的规律与B和C体系浓度叠加后基本一致, 这也说明EPS对生物膜产生H2O2的协同作用不明显. 由图7(F)可见, pH值对体系的影响规律与B体系一致, 但H2O2的生成量明显少于B体系, 再次说明EDTA能够抑制生物膜产生H2O2. 同时, 有研究表明, 不同pH值条件下铁离子与EDTA会以不同的结合形式存在, 当体系pH值为8和9时, 铁离子与EDTA出现FeⅢ EDTA(OH
2.3.2 DOM浓度的影响 不同浓度DOM的体系中H2O2浓度的变化如图8所示. 由图8(A)可见, EPS浓度为2 mg/L时C体系中H2O2的生成量就明显增加, EPS浓度越高, H2O2的生成量越多, 但差距并不十分明显. 3 h后不同浓度EPS体系H2O2浓度均有下降, 且速率相近, 说明其浓度下降受EPS降解量的影响较小, 而EPS结构和性质的改变可能是主要影响因素. 对于图8(B), 如前所述, EDTA本身对H2O2的分解没有显著影响, 因此EDTA浓度的增加对D体系中H2O2浓度影响不大. 图8(C)表明E体系中H2O2的生成量随EPS浓度的增加而稍有上升, 总体呈现先快后慢的增加趋势. EPS浓度的增加对体系H2O2浓度上升作用不大, 这也说明EPS对生物膜的协同作用并不明显. 由图8(D)可见, 随着EDTA浓度的增加, F体系中H2O2浓度上升的速率明显降低. 这可能是由于随着EDTA浓度的升高, 其与金属配合能力增强, 因而对生物膜产生H2O2的抑制作用更强.
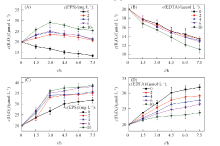 | Fig.8 Changes of H2O2 concentration in C— F systems(A— D) with different DOM concentrations under illumination |
2.3.3 DO的影响 增氧与未增氧条件下各体系H2O2浓度的变化情况见图9. 可以明显看出, 增氧体系中H2O2的浓度均比未增氧体系的高, 表明DO对H2O2的生成有显著影响[1]. A体系的H2O2浓度缓慢下降, 且增氧体系H2O2浓度比未增氧体系降低速率稍慢, 说明DO对H2O2的分解有一定的抑制作用. 对比图9(A)和(B)可见, DO对EPS产生H2O2有显著促进作用, 反应式(2), (4)和(5)中, DO在DOM产生H2O2的2种途径中的作用也证明了这一点. 对于B, E, F体系, DO除抑制了H2O2的分解外, 对生物膜也有明显的影响, 有研究认为, 体系DO的增加可能会促进生物膜中藻类的生长代谢, 从而使生物膜的光合作用加强, 进而促进生物膜产生H2
DOM是自然水体的重要组成部分, 在保持水体理化性质、 参与水体物质能量循环等方面具有重要作用[33]. 同时, 已有大量相关研究表明DOM能影响污染物的光化学行为[32, 33, 35]. 如前所述, 生物膜及DOM在光照条件下均能产生H2O2等ROS, 从而影响有机污染物在水环境中的降解和生态效应[43]. DOM成分复杂, 其不同组分的结构与性质差异较大. 本研究发现DOM的高分子成分生物膜EPS由于具有发色基团, 有较强的吸光能力, 在光照下能够产生H2O2, 但对生物膜产生H2O2没有明显影响, 与生物膜共存时通过产生H2O2而起到增加体系H2O2浓度的作用; 而小分子EDTA在光照下本身不能产生H2O2, 但由于其较强的配合能力, 会显著抑制生物膜产生H2O2, 从而在与生物膜共存时起到降低体系H2O2浓度的作用. 此外, DOM中的其它成分, 如腐殖酸、 富里酸等, 可能类似于EPS和EDTA, 对生物膜产生H2O2的过程具有显著但不同的影响, 值得进一步研究. 可见, DOM的共存对可见光照下的生物膜体系中H2O2的生成和浓度有复杂的影响, 进而影响水体中污染物的环境行为.
DOM对可见光照射下自然水体生物膜体系中H2O2的生成有重要而复杂的影响. 以生物膜EPS为代表的高分子DOM自身在光照条件下能产生H2O2, 其对生物膜产生H2O2的影响不显著; 以EDTA为代表的小分子DOM本身不能产生H2O2, 但会显著抑制生物膜产生H2O2. EPS和生物膜在中、 低pH值体系中产生H2O2的量均高于高pH值体系, EDTA在高pH值下抑制生物膜产生H2O2的作用更显著. EPS浓度的增加对生物膜产生H2O2的影响不明显, 而EDTA浓度的增加会显著抑制生物膜产生H2O2. 体系DO的上升会抑制H2O2的分解, 同时会显著促进EPS和生物膜产生H2O2.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|