联系人简介: 于广利, 男, 博士, 教授, 博士生导师, 主要从事糖化学和糖药物学方面的研究. E-mail: glyu@ouc.edu.cn
刺松藻(Codium fragile)经水提-醇沉获得粗多糖, 进一步将刺松藻粗多糖(CFP) 通过Q-Sepharose Fast Flow(QFF) 阴离子交换柱纯化得到6个多糖组分CFP1CFP6, 其中, 在CFP6中发现纯度较高的阿拉伯聚糖. 采用高效凝胶渗透色谱与十八角激光散射仪联用法和1-苯基-3-甲基-5-吡唑啉酮(PMP)柱前衍生高效液相色谱法对CFP6的分子量及单糖组成进行了分析. 结果表明, CFP6是一种分子量为79290的多糖, 由阿拉伯糖(Ara)和半乳糖(Gal)组成, 二者摩尔比为14.8:1.0. 通过多维核磁共振波谱、 液相色谱-质谱联用及二级质谱等方法对CFP6的糖苷键连接方式及其寡糖序列结构进行表征, 进一步阐明了该复杂多糖的特征结构. 经判断, CFP6主链由Ara组成, 通过 β-(1→3)糖苷键连接, 在Ara的C2位存在分支结构, 硫酸基位于Ara的C4或C2位.
The crude polysaccharide was obtained from Codium fragile by water extracted and alcohol precipitated, and further 6 fractions purified by Q-Sepharose fast flow column were named CFP1—CFP6, respectively. CFP6 is a higher purity arabinose of them. The absolute molecular mass of the main fraction CFP6 was determined by high performance gel permeation chromatography and laser scattering instrument. The monosaccharide composition was analyzed by reversed phase high-performance liquid chromatography(RP-HPLC) labeled with 1-phenyl-3-methyl-5-pyrazolone(PMP). The results showed that CFP6 is a homogeneous polysaccharide component with a molecular weight of 79290 and consists of arabinose(Ara) and galactose(Gal) with a molar ratio of 14.8:1.0. Subsequently, the structural features and oligosaccharide sequence composition were identified by multi-dimensional nuclear magnetic resonance spectroscopy and liquid chromatography-mass spectrometry, further to elucidate the fine structure of the complex polysaccharide. The results revealed that the backbone of CFP6 is β-(1→3)-linked arabinan and sulfate group is located at the C4 or C2 positions. CFP6 is a higher purity arabinose and its extensive structure information can enrich the marine carbohydrate data and provides a methodological reference for the study of complex polysaccharide structures.
刺松藻(Codium fragile)属绿藻门(Chlorophyta) 松藻属(Codium)植物, 为泛暖温带性海藻, 在我国沿海地区广泛分布. 刺松藻主要含有糖类化合物, 蛋白质含量较高, 且富含矿物元素, 具有良好的应用前景和开发价值[1], 作为一种重要的绿藻资源已成为研究热点. 研究表明, 刺松藻多糖主要含有水溶性硫酸多糖、 葡萄聚糖及半乳聚糖等[2]. 硫酸多糖具有抗病毒[3]、 抗肿瘤[4]、 免疫调节[5]和抗凝血[6]等多种生物活性, 其活性与分子量大小[7]、 单糖组成、 硫酸基取代位置及含量[8, 9]等结构特征密切相关. 确定多糖的明确结构对研究其构效关系和分子机制等以及充分开发利用藻类多糖资源具有重要意义. 然而, 刺松藻硫酸多糖的连接方式及硫酸基位点复杂, 为多糖结构解析带来一定困难.
液相色谱-质谱联用技术具备高选择性和高灵敏度的特点[10, 11], 在糖胺聚糖[12]、 糖肽[13]、 糖链的结构及含量[14]等糖组学的分析中得到广泛应用. 基于其在糖类化合物分析上的优势, 将其应用于刺松藻硫酸多糖的寡糖结构序列分析, 可以进一步阐明刺松藻多糖的特征结构.
本文以刺松藻为原料经冷水提取粗多糖, 再经Q-Sepharose Fast Flow阴离子交换色谱柱纯化得到硫酸阿拉伯糖, 采用核磁共振波谱(NMR)和自由基降解联合亲水相互作用液相色谱(HILIC)-傅里叶变换质谱(FTMS)对多糖结构进行了表征, 为刺松藻中硫酸阿拉伯聚糖的综合开发提供了数据支持.
刺松藻(Codium fragile)购于荣成海利水产食品有限公司, 经中国海洋大学海洋生命学院宫相忠教授鉴定为松藻科(Codiaceae)松藻属(Codium)植物刺松藻. 单糖标准品甘露糖(Man)、 葡萄糖胺(GlcN)、 鼠李糖(Rha)、 葡萄糖醛酸(GlcA)、 半乳糖醛酸(GalA)、 半乳糖胺(GalN)、 葡萄糖(Glc)、 半乳糖(Gal)、 木糖(Xyl)、 阿拉伯糖(Ara)和岩藻糖(Fuc), 以及1-苯基-3-甲基-5吡唑啉酮(PMP)、 三氟乙酸和硼氢化钠均购于美国Sigma公司; 乙腈和醋酸铵(色谱纯)购于德国Merck公司; 其它化学试剂为分析纯; Q-Sepharose Fast Flow阴离子交换树脂(美国GE公司); Sepharose 6B Fast Flow凝胶过滤填料(美国Bio-Rad公司); Shodex OHpak SB HQ 802.5/804色谱柱(300 mm× 8.0 mm, 6 μ m, 日本昭和电工公司); Agilent Eclipse XDB-C18色谱柱(4.6 mm× 150 mm, 5 μ m, 美国Agilent公司); Luna HILIC色谱柱(150 mm× 2.00 mm, 3 μ m, 美国Phenomenex公司); Carbograph SPE固相萃取柱(美国Supelco公司).
R-410型旋转蒸发仪(瑞士BÜ CHI公司); ELx808 型酶标仪(美国Bio Tek公司); Ä KTA purifier UPC 900型纯化系统(美国GE公司); Agilent 1260型高效液相色谱仪(美国Agilent公司); DAW N HELE505Ⅱ 型多角激光光散射仪(美国Wyatt公司); Agilent 1290 LC UPLC系统(美国Agilent公司); LTQ Orbitrap XL质谱仪(美国Thermo公司); Jeol JNM ECP 600 MHz超导核磁共振波谱仪(日本电子株式会社).
1.2.1 CFP6的分离纯化 刺松藻经干燥、 粉碎、 过40目筛, 用体积分数为85%的乙醇回流脱脂后, 进行烘干处理, 脱脂粉经冷水提取后离心, 上清液经浓缩、 醇沉、 透析、 冻干提取得粗多糖(CFP). 参考文献[15]方法分离纯化CFP6. 采用硫酸-苯酚法[16]定性检测, 收集主峰产品, 经浓缩、 透析脱盐, 冻干得组分CFP6.
1.2.2 绝对分子量的测定 参考文献[17]方法, 采用高效凝胶渗透色谱-多角度激光散射联用仪(HPGPC-MALLS)测定纯化组分CFP6的分子质量并检测其纯度. 用Astra 5.3.4.20软件分析数据, 计算多糖的重均分子量(Mw)及数均分子量(Mn).
1.2.3 单糖组成测定 参考文献[18] 方法, 采用三氟乙酸封管水解方法对CFP6样品进行降解, 用PMP柱前衍生高效液相色谱法测定单糖组成. 根据出峰时间及峰面积确定和计算样品的单糖组成及其摩尔比.
1.2.4 红外光谱测定 将CFP6样品置于装有P2O5的真空干燥箱中, 于45 ℃干燥至恒重, 取12 mg样品用KBr压片, 在4000400 cm-1范围内进行红外光谱扫描.
1.2.5 核磁共振波谱测定 将30 mg CFP6样品用0.5 mL D2O溶解, 真空减压浓缩D2O交换3次, 冷冻干燥后, 用0.5 mL D2O溶解并加入到核磁管中, 进行核磁共振波谱测定, 以氘代丙酮为内标.
1.2.6 寡糖结构及序列分析 采用自由基降解方法降解CFP6获得其寡糖组分[19]. 取1 mg CFP6样品溶解于300 μ L 50 mmol/L乙酸钠-乙酸缓冲液, 依次加入10 μ L 10 mmol/L乙酸铜溶液和40 μ L质量分数为3%的过氧化氢溶液, 于45 ℃反应3 h. 加入亚硫酸钠, 除去未反应的过氧化氢以终止反应. 将反应液通过Carbograph SPE柱脱盐纯化, 依次用3 倍柱体积的水和50%乙腈[乙腈/水体积比为1: 1, 含有0.1%(体积分数)三氟乙酸TFA]洗脱, 冻干. 将冻干粉末重新溶解于20 μ L 50%的乙腈中, 进行亲水作用色谱-傅里叶变换质谱(HILIC-FTMS)分析. 色谱柱为Luna HILIC色谱柱, 进样体积5 μ L; 流动相为5 mmol/L 醋酸铵/98%乙腈(A)和5 mmol/L 醋酸铵/H2O(B); 柱温25 ℃; 流速150 μ L/min. ESI-MS采用负离子检测模式, 喷雾电压为4.2 kV, 毛细管温度275 ℃, 鞘气流速40 L/min, 质谱扫描范围m/z 1002000. 采用Xcalibur 2.0软件和GlycReSoft 1.0软件进行数据采集和分析.
将上述寡糖冻干样品溶于25 μ L 0.05 mol/L NaBH4 溶液中进行还原, 混合物于4 ℃反应过夜后, 用乙酸中和至pH=7. 经2倍体积乙醇沉淀, 离心后取上层清液, 除去乙醇后冻干. 还原后的冻干样品经Carbograph SPE柱脱盐, 方法同上; 再将样品重新溶解于20 μ L 50%乙腈中用于HILIC-FTMS分析.
刺松藻经水提和醇沉获得粗多糖, 进一步通过QFF阴离子交换柱和凝胶柱层析纯化, 获得纯化多糖CFP1CFP6, 其中CFP6产率为8.74%. 通过HPGPC-MALLS分析对CFP6的分子量进行测定, 经计算得出CFP6的Mw和Mn分别为79290和69110, 分散指数(Mw/Mn)为1.15. 采用PMP-柱前衍生高效液相色谱对CFP6的单糖组成进行了分析, 结果如图S1所示(见本文支持信息), CFP6主要由Ara组成, 还含有少量的Gal, 二者摩尔比为14.8: 1.0, 说明CFP6为一种阿拉伯聚糖. 其它纯化组分的理化性质列于表S1(见本文支持信息).
在多糖CFP6的红外光谱(图S2, 见本文支持信息) 中, 3444 cm-1处的强吸收峰归属为O— H的伸缩振动, 2920和1381 cm-1处的吸收峰归属为C— H的伸缩振动和弯曲振动, 886 cm-1处的吸收峰归属为β 型阿拉伯吡喃糖C— H的变角振动, 846和820 cm-1处的吸收峰分别归属为4-硫酸基-β -L阿拉伯糖上C— O— S的伸缩振动和2-硫酸基-β -L阿拉伯糖上C— O— S的伸缩振动. 由此可初步判断, CFP6为β -吡喃型多糖.
根据上述结果及文献[20, 21, 22, 23, 24, 25]报道的糖基核磁共振波谱的化学位移, 对CFP6在一维核磁共振(1H NMR, 13C NMR)和二维核磁共振(HMBC, HMQC)中的信号进行归属(图1). 具有呋喃环的碳原子其共振位置要低于对应吡喃环的各种碳原子, β 构型的异头碳共振位置高于α 构型的异头碳, 吡喃型β -阿拉伯糖的C1对应δ 96.6, 呋喃型α -Ara的C1对应δ 102.6. CFP6的C1对应δ 95.3, 与吡喃型β -Ara核磁信号一致, 进一步证明CFP6为β -型吡喃阿拉伯聚糖. 结合文献[23, 24, 25]结果, 推测δ 5.15为β -Ara的H1信号, 其余H2H5的化学位移在δ 3.614.08之间. 由核磁共振结果对糖片段进行初步判断, HMQC谱[图1(B)]显示CFP6主要存在4种类型的糖残基类型, 结果如表1所示. δ 4.71/73.27是阿拉伯糖C2— OH位被硫酸基取代的信号峰; δ 4.85/74.85是阿拉伯糖C4— OH位被硫酸根取代的信号峰. δ 4.29/73.14和3.79/72.94是C2和C4被硫酸化后, 邻位C3和C5位向低场移动的结果. 结合HMBC谱[图1(C)]分析, 相关峰δ 5.10/70.23和δ 5.10与A的H1最接近, δ 70.23与C/D的C3接近, 因此A可能通过糖苷键(1→ 3)与C或D相连. 其它相关峰可能为不同重复片段的信号.
 | Fig.1 NMR spectra of polysaccharide CFP6 obtained from C. fragile in D2O at 25 ℃ (A) 1H-1H COSY spectrum; (B) 1H-13C HMQC spectrum; (C) 1H-13C HMBC spectrum. |
| Table 1 Chemical shifts(δ ) for the resonances of glycosyl residues of CFP6 in 1H and 13C NMR spectra |
利用LC-ESI-MS技术可获得混合样品中单一成分的质谱图, 便于寡糖聚合度、 主链序列和分支位点的分析[26]. 多糖CFP6经自由基解聚后, 采用HILIC-FTMS测定分析其寡糖的精细结构. 基于HILIC-FTMS分析的CFP6寡糖的总离子色谱图如图2(A)所示. 采用Decon Tools对原始数据进行去卷积处理, 然后用GlycResoft处理Decon Tools的输出结果以生成匹配结构, 并根据离子丰度标准化, 获得了主要低聚糖相对定量结果[图2(B)], 发现寡糖组分以A2S2为主.
根据LC-MS/MS谱图进一步对CFP6的寡糖主要片段(聚合度为25)结构进行解析, 得出主要序列结构见图3和图4.
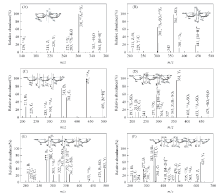 | Fig.3 ESI-MS/MS spectra of CFP6 oligosaccharides and reduced oligosaccharides A2S1(A), A2S2(B), A3S1(C), A3S2(D), A4S2(E) and A5S2(F)(free acid form of oligosaccharides) |
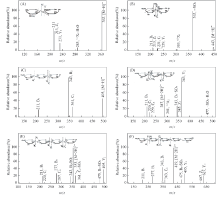 | Fig.4 ESI-MS/MS spectra of CFP6 oligosaccharides and reduced oligosaccharides A2S1(A), A2S2(B), A3S1(C), A3S2(D), A4S2(E) and A5S2(F)(alditol form of reduced oligosaccharides) |
A2S1(dp2)二糖的ESI-MS/MS序列分析结果见图3(A), 分子离子峰为m/z 361. 0, 2A2(m/z 301)碎片离子排除了1→ 2连接的可能, 0, 3A2(m/z 139) 碎片离子排除了1→ 4连接的可能, 所以为1→ 3连接. 为确定重复单元的还原末端, 通过NaBH4还原寡糖混合物并获得了糖醇产物的质谱图, 如图4(A)所示. Z1(m/z 211) 和Y1(m/z 229)还原后变为m/z 213和m/z 231, 表明硫酸基位于还原端的C4位. 故该二糖的序列应为Arbpβ 1→ 3Arbp4S. A2S2(dp2)二糖的分子离子峰为m/z 441[图3(B)]. 还原后寡糖Z1和Y1增加2 Da[图4(B)], 而B1和C1没有增加2 Da, 说明硫酸基位于2个阿拉伯糖上. 由 0, 2A(m/z 381)碎片离子说明连接方式为1→ 3连接, 且硫酸基位于C4位. 由0, 3X(m/z 301)碎片离子排除了C2硫酸基的存在, 所以非还原端的硫酸基位于C4位. 经解析, 该二糖的序列应为Arbp4Sβ 1→ 3Arbp4S. A3S1(dp3)三糖的分子离子峰为m/z 493[图3(C)]. 还原后寡糖B1(m/z 211)没有增加2 Da[图4(C)], 表明硫酸基位于非还原端. 0, 2A(m/z 433, 301)碎片离子说明连接方式为1→ 3连接. 由m/z 151碎片离子可知硫酸基位于非还原端的C4位. 故该三糖的序列应为Arbp4Sβ 1→ 3Arbpβ 1→ 3Arbp. A3S2(dp3)的ESI-MS/MS序列分析结果见图3(D). 该三糖的双电荷分子离子峰为m/z 286. 由还原后寡糖C2(双电荷离子峰m/z 220)没有增加2 Da, 可知硫酸基位于非还原端的2个阿拉伯糖上. 0, 2A(m/z 433, 301)和0, 2X1(m/z 271)碎片离子说明连接方式为1→ 3连接, 且中间糖环硫酸基位于C2位. 由于C2位硫酸基易脱落, 因此推测硫酸基位于非还原端C4位. 故该三糖的序列应为Arbp4Sβ 1→ 3Arbp2Sβ 1→ 3Arbp. A4S2(dp4)四糖的双电荷分子离子峰为m/z 352[图3(E)]. 其中双电荷离子峰有m/z 220, 277, 286和322. 由还原后寡糖C2(双电荷离子峰m/z 220)没有增加2 Da[图4(E)], 表明硫酸基位于非还原端的2个阿拉伯糖上. 0, 2A(m/z 322, 433, 301)碎片离子说明连接方式为1→ 3连接, 且硫酸基位于第2个糖环的C2位, 同理推测硫酸基位于非还原端C4位. 经解析, 该四糖的序列应为Arbp4Sβ 1→ 3Arbp2Sβ 1→ 3Arbpβ 1→ 3Arbp. A5S2(dp5)五糖的双电荷分子离子峰为m/z 418[图3(F)]. 其中, 双电荷离子峰有m/z 220, 277, 286, 343和352. 还原后寡糖B1没有增加2 Da[图4(F)], 表明1个硫酸基位于非还原端的阿拉伯糖上. 0, 2A(m/z 565, 433, 301)碎片离子说明连接方式为1→ 3连接, 而还原端连接方式为1→ 2连接, 且硫酸基位于第3个糖环的C2位, 非还原端硫酸基可能位于C4或C2, 同法推断硫酸基在非还原端C4位. 经解析, 该五糖的序列应为Arbp4Sβ 1→ 3Arbpβ 1→ 3Arbp2Sβ 1→ 3Arbpβ 1→ 2Arbp.
各组分中均无Gal存在, 表明Gal应该位于该多糖的支链或末端, 容易被降解. 结合获得的寡糖结构信息和NMR表征结果, 推测CFP6多糖的结构是以β -(1→ 3)为主链, 支链或末端含有少量Gal, 硫酸基主要位于C4或C2位的杂合硫酸阿拉伯聚糖. 松藻与刚毛藻(Cladophora glomerata Kü tzing)是阿拉伯糖含量较高的绿藻. 本文经1.4 mol/L氯化钠洗脱纯化得到CFP6多糖, You等[27]研究发现, 在刚毛藻中提取分离的水溶性硫酸多糖组分中, 主要含有Ara(41.7%54.4%), Gal(13.5%39.0%), Glu(0.80%10.6%), Xyl(6.84%13.4%)和Rha(0.20%2.83%), 分子量为3580001501000. 与之相比, CFP6的Ara含量更高; 而拳状松藻[28](Codium pugniformis)和不同来源的刺松藻[9]中, Ara含量相对较少且单糖组成较复杂. CFP6中Ara不仅含量更高, 且成分更单一, 利于进一步评价该类糖化合物的构效关系. 本文通过自由基降解法与液相色谱-质谱联用方法对硫酸阿拉伯寡糖进行序列分析, 其结果丰富了海洋特征糖库.
从刺松藻多糖中分离纯化出阿拉伯聚糖组分CFP6, 研究了其理化性质, 并对其化学结构进行表征. 结果表明, CFP6由Ara和Gal组成, 其摩尔比为14.8: 1.0, 主链由Ara组成, 通过 β -(1→ 3)糖苷键连接, 在Ara的C2位存在分支结构, 硫酸基位于Ara的C4或C2位, Gal位于该多糖的支链或末端. 多糖CFP6组成较简单, 主成分Ara含量较高, 寡糖序列的分析结果为硫酸阿拉伯糖的综合开发与利用提供了依据.
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/cjcu20180583.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|



