联系人简介: 穆晓清, 男, 博士, 副教授, 主要从事生物化工及酶工程方面的研究. E-mail: xqmu@jiangnan.edu.cn
构建了亮氨酸脱氢酶(LeuDH)催化的底物偶联反应体系, 打破氧化脱氨反应平衡, 同时制得高附加值的α-酮异己酸(α-KIC)和L-2-氨基丁酸, 并实现辅酶NAD+的高效循环再生. 基于LeuDH的底物专一性和催化动力学参数, 考察了不同酮酸底物对于底物偶联反应效率的影响, 选择转化率最高的2-丁酮酸作为偶联底物, 使α-KIC产率由单步氧化反应的2.75%提高至66.82%. 通过考察底物浓度、 pH值、 N
In order to shift the balance of oxidative deamination, the substrate coupling reaction system catalyzed byleucine dehydrogenase(LeuDH) was constructed. The α-KIC and L-2-aminobutyrate with high valuable were synthesized. Meanwhile, the coenzyme was efficiently regenerated. Based on the studies of the substrates specificity and kinetic parameters of LeuDH, the efficiency of substrate coupling reaction was compared using a series of ketonic acids. The result showed that 2-oxobutyrate could be used as the best coupling substrate. The yield of α-KIC was improved from 2.75% of the single-step oxidation reaction to 66.82% of the coupling reaction. The reaction conditions were optimized, including pH values, concentrations of substrate, N
α -酮异己酸(α -KIC)具有双羰基结构, 能够刺激胰岛素分泌[1, 2], 抑制胰高血糖素分泌[3, 4]和抑制蛋白分解[5, 6], 是药物和有机合成的重要中间体; 还可为慢性肾病患者补充营养[7]、 促进肌肉生长[8]、 合成杂环化合物[9]和改善食品风味[10]等, 因而广泛应用于医药[11, 12, 13]、 动物饲料[14]、 化工[15]和食品等行业.
α -KIC的工业生产大多采用双羧基化法、 水解法、 氧化法和海因法等化学合成法. 化学方法工艺原料复杂、 步骤冗长且环境污染严重, 因此利用环境友好的生物法制备α -KIC成为发展趋势. 相对于转化率低、 副产物多、 成本高的发酵生产法, 生物转化法因其合成步骤简单、 副产物少的特点, 而成为生物绿色合成α -KIC的首选. 具有价格经济性优势的L-亮氨酸是生物转化的理想底物, 通过转氨酶(AT, EC2.6.2.X)[16]、 氨基酸氧化酶(AAO, EC1.4.3.2和EC1.4.3.3)[17, 18, 19]以及氨基酸脱氢酶(AADH, EC1.4.1.X)等酶均可实现氨基氧化脱氨制备α -KIC, 是最有工业应用价值的制备途径. 目前, 关于AAO和AT方法制备α -KIC的研究较多, 但AAO法会产生副产物H2O2, 对细胞或者酶具有明显的毒性和抑制作用; AT法则存在底产物抑制、 转化率较低及成本较高等问题[20]. 而氨基酸脱氢酶能够同时可逆催化氨基酸氧化脱氨和酮酸还原胺化反应, 但反应选择性倾向于还原胺化方向[21], 且需要等摩尔辅酶参与[22], 途径实现困难较大, 研究较少.
近年来, 对氨基酸脱氢酶的催化机制和合成应用研究不断深入[23]. 亮氨酸脱氢酶(LeuDH, EC1.4.1.9)是研究最为广泛和深入的氨基酸脱氢酶, 其底物专一性和催化特性研究为构建新型α -KIC合成路线提供了基础[24]. LeuDH能够可逆催化氨基酸和酮酸之间的相互转化, 是重要的氨基酸和酮酸制备用生物催化剂[25]. 本文针对LeuDH对酮酸高活力, 能够偶联辅酶循环等特点, 构建了底物偶联反应途径, 如Scheme 1所示. 偶联高效酮酸还原反应具有改变反应平衡、 提高转化率、 联产L-2-氨基丁酸及直接实现辅酶原位再生等优点, 实现了高效生产α -KIC.
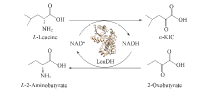 | Scheme 1 Schematic illustration of substrate coupling reaction catalyzed by LeuDH for production of α -KIC and L-2-aminobutyrate |
亮氨酸脱氢酶重组表达菌株E. coli BL21/pET28a-L(GenBank Accession No.CP000227.1)由本实验室构建并保存. 卡那霉素、 异丙基-β -D-硫代半乳糖苷(IPTG)和三羟甲基氨基甲烷(Tris)均购自上海生工生物工程技术有限公司; 辅酶购自上海索莱宝生物科技有限公司; 邻苯二甲醛衍生剂(OPA)购自Agilent公司; 其它试剂均购自国药集团化学试剂有限公司.
Aglient 1260型反相高效液相色谱仪(HPLC, 美国Aglient公司); Diamonsil C18色谱柱(250 mm× 4.6 mm, 北京Dikma公司); CroCube F570型超低温冰箱(德国Eppendorf公司); VCX750型超声破碎仪(美国Sonic公司); Cytation3型酶标仪(美国BioTek公司).
1.2.1 菌体培养 Luria-Bertani(LB)液体培养基: 蛋白胨(10.0 g/L)+NaCl溶液(10.0 g/L)+酵母提取物(10.0 g/L). 将E. coli BL21/pET28a-L接种到5 mL LB(含50 μ g/mL卡那霉素)液体培养基中, 于37 ℃搅拌(200 r/min)下培养8 h后, 转接到500 mL LB液体培养基中; 于37 ℃搅拌(200 r/min)下培养至OD600在0.60.8之间. 加入IPTG(0.1 mmol/L), 于17 ℃搅拌(200 r/min)诱导表达17 h.
1.2.2 LeuDH酶活力的测定 测定酶活的反应体系为0.2 mL, 包含Tris-HCl(0.1 mol/L, pH=8.5)、 底物(5 mmol/L)、 NADH/NAD+(0.2 mmol/L)及适量纯酶液, 于30 ℃保温2 min, 在340 nm波长下测定吸光度值.
1.2.3 LeuDH偶联反应体系的构建 偶联反应体系为2 mL, 包含Tris-HCl缓冲溶液(0.1 mol/L)、 L-亮氨酸(100 mmol/L)、 2-丁酮酸(100 mmol/L)、 纯酶液(0.5 U/mg)及NAD+(0.01 μ mol/L), 于30 ℃搅拌(200 r/min)反应6 h.
1.2.4 产物的HPLC分析 酮酸的HPLC检测采用视差检测器, 柱温60 ℃, 流动相为5 mmol/L稀硫酸, 流速0.6 mL/min, 进样量10 μ L. 氨基酸检测先利用OPA进行在线衍生, 再进行液相色谱检测. 色谱条件: 紫外检测波长338 nm, 柱温40 ℃, 流速1 mL/min, 进样量10 μ L; 流动相A为20 mmol/L醋酸钠, 用质量分数1%的稀乙酸调pH=7.2; 流动相B为醋酸钠/甲醇/乙腈溶液(体积比2: 4: 4, 20 mmol/L, pH=7.2); 洗脱程序: 27 min内B组分体积分数由7%升至50%, 4 min内再升至80%, 保持3 min, 然后在1 min内降至7%, 保持3 min(总时间38 min).
LeuDH能可逆催化部分脂肪族氨基酸氧化脱氨和酮酸的不对称还原胺化反应, 是氨基酸和酮酸合成的生物途径, 但根据该酶已报道的酶学性质及应用研究, 热力学上反应平衡倾向于还原方向[26].
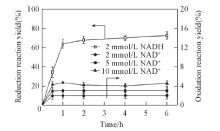
图1给出LeuDH氧化L-亮氨酸(L-Leucine)生成α -KIC和不对称还原α -KIC生成L-亮氨酸单步反应效率. 可见, 反应1 h后, 还原反应和氧化反应基本达到平衡, 但是两反应效率差异显著. LeuDH氧化L-亮氨酸生成α -KIC产率为2.75%, 而还原酮酸的产率达到72.73%, 为氧化反应产率的18倍. 研究中发现, 仅仅提高氧化性辅酶浓度对于提高氧化反应产率无明显作用.
进一步对LeuDH催化单步氧化脱氨和不对称还原胺化反应动力学进行了研究. 由表1可见, 尽管LeuDH对L-亮氨酸氧化脱氨反应的比活力是不对称还原胺化反应的15%, 但其催化效率(kcat/Km)仅为不对称还原胺化反应的0.04%. 动力学参数Vm(酶完全被底物饱和时的反应速度)和Km(酶促反应的初速率为最大速率Vm一半时的底物浓度)研究表明, LeuDH催化氧化脱氨和不对称还原胺化的反应平衡倾向于氨基酸合成方向, 因此直接用LeuDH氧化L-亮氨酸脱氨制备α -KIC不仅存在化学平衡的抑制问题, 也存在NAD+等摩尔消耗的制约. 因此, 通过构建偶联反应以破坏原有反应平衡, 同时实现辅酶的高效再生是提高LeuDH氧化脱氨制备α -KIC效率的有效途径. 辅酶再生偶联反应包括底物偶联与酶偶联, 酶偶联法通过多酶催化的辅酶氧化态和还原态的转化实现不同反应的偶联[27, 28]; 而底物偶联利用单种酶同时催化2种反应实现辅酶再生, 具有不可逆性、 还原力强及减少辅底物过剩特点[29]. 故底物偶联方法可作为提高α -KIC和L-2-氨基丁酸产率的首选.
| Table 1 Enzymatic oxidation and reduction properties of LeuDH for L-leucine and α -KIC |
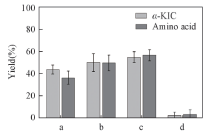
LeuDH催化的酶偶联法已多有报道[30, 31], 但是底物偶联法鲜见报道. 本文将酮酸与L-亮氨酸偶联构成底物偶联反应途径. 根据LeuDH的底物专一性[32], LeuDH对三甲基丙酮酸、 2-丁酮酸、 3-甲基-2-丁酮酸和丙酮酸均具有较高酶活, 因此选择这4种酮酸与L-亮氨酸偶联(图2). 可见, 2-丁酮酸与L-亮氨酸偶联反应生成α -KIC的产率最高, 故选择2-丁酮酸和L-亮氨酸进行偶联研究. 同时, 2-丁酮酸还原产物L-2-氨基丁酸是一种高附加值的非天然手性氨基酸, 是重要的医药中间体, 不仅能够合成内皮素拮抗因子[33], 还能抑制人体神经信息的传递和促进脑细胞代谢[32].
由表2可见, LeuDH对大部分脂肪族酮酸具有较高的活力, 这与文献[34]报道的其它LeuDH一致. LeuDH对不同底物的动力学研究表明, LeuDH对3-甲基-2丁酮酸和2-丁酮酸具有较高的kcat/Km值, 反应转化效率分别达到66.82%和73.73%. 而对三甲基丙酮酸的kcat/Km值较小, 仍有较高的转化率, 由于LeuDH还原三甲基丙酮酸具有不可逆性, 使反应平衡不断向还原方向持续进行, 反应转化效率达到65.46%.
| Table 2 Enzymatic oxidation and reduction properties of LeuDH for different kinds of amino acids and ketonic acids |
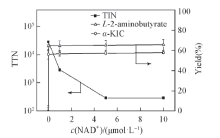
2.3.1 辅酶浓度对底物偶联反应效率的影响 对于辅酶再生体系, 评价反应效率的主要指标包括辅酶的总转化数(TTN)和产物浓度. TTN是反映辅酶循环利用效率的重要指标, 也是评价辅酶是否有良好再生能力的标准[35]. 通常认为TTN达到103105的生物转化才具有经济效益, 在实验研究中认为TTN达到100以上才是可行的[36]. 图3示出了不同浓度NAD+对产率和TTN的影响. 结果表明, 当辅酶浓度为0.01 μ mol/L时, 偶联反应的TTN最高可达5.88× 105, 已达到工业化水平, 说明辅酶NAD+具有很好的再生能力, 可以大大降低成本; 而且α -KIC和L-2-氨基丁酸对应的产率分别为58.77%和65.57%. 随着辅酶浓度从0.01 μ mol/L提高到10 μ mol/L, 产物α -KIC和L-2-氨基丁酸的产率基本不变, 但是偶联反应的TTN却显著降低, 说明辅酶的加入量对反应的产率影响较小, 仅添加少量的辅酶即可启动反应必需辅酶的循环再生, 实现偶联反应持续进行.
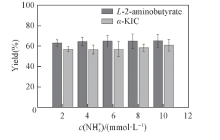
2.3.2 N
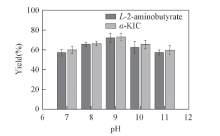
2.3.3 pH值对底物偶联反应效率的影响 在生物催化反应中, 反应体系的pH值会对底物和酶的离子状态产生影响, 尤其对酶活性中心的极性, pH值的改变不仅会影响酶的活性, 还会对辅酶再生能力产生影响[37]. 由图5可见, 当pH值过低或过高时产率均较低, 其原因是pH值过高和过低均会影响酶的分子构象[38]; 在pH=7.09.0时, 随着pH值的增大产率不断增加, 表明pH=9为最适pH值.
2.3.4 底物浓度对底物偶联反应效率的影响 在生物催化反应过程中, 底物加载量是关键, 通常无法避免底物抑制现象发生[39]. 由图6可见, 底物浓度低于100 mmol/L时, 产率随着底物浓度增大而增大; 但是当底物浓度大于100 mmol/L时, 随着底物浓度增加产率逐渐下降, 说明存在底物抑制问题.
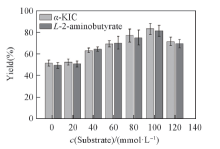 | Fig.6 Effects of substrate concentration on the yield of α -KIC All reactions were carried out in 2 mL Tris-HCl buffer(0.1 mol/L, pH=8.5) comprising L-leucine, 2-oxobutyrate and NAD+(0.01 μ mol/L). |
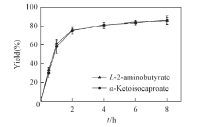
2.3.5 转化过程曲线 由图7可见, 转化时间为02 h时, 生成α -KIC的产率迅速增加至74.95%; 转化时间为26 h时, 生成α -KIC和L-2-氨基丁酸的产率缓慢增加; 在6 h以后, 随着转化时间增加, 产率几乎不变. 由此可确定转化时间为6 h时, α -KIC产率最佳达到83.25%.
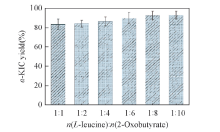
由图8可见, 当L-亮氨酸/2-丁酮酸摩尔比由1: 1增加至1: 8时, α -KIC的产率从83.25%增加至92.74%; 当摩尔比由1: 8继续增加至1: 10时, α -KIC的产率几乎不变, 仅仅增加了0.41%. 这说明提高2-丁酮酸的摩尔比, 可以改变反应平衡, 拉动反应平衡向生成α -KIC方向进行, 增大产物转化率, 同时当2-丁酮酸浓度过高时会产生底物抑制现象, 导致α -KIC的产率几乎不变.
基于亮氨酸脱氢酶(LeuDH)氧化脱氨制备酮酸活力低, 需要等摩尔辅酶等限制, 利用偶联酮酸构建了底物偶联反应体系. 以2-丁酮酸作为偶联底物, 打破LeuDH氧化脱氨反应平衡, 使α -KIC的产率从2.75%提高至66.82%, 实现同时制备α -KIC和L-2-氨基丁酸. 通过进一步优化偶联反应条件, 使产率提高至83.25%, 辅酶总转化数(TTN)达到5.88× 105; 通过调节氨基酸和酮酸比例可以将产率进一步提高至92.74%. 本文结果为α -KIC的绿色生产提供了一条有效途径.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|