联系人简介: 尹静波, 女, 博士, 教授, 主要从事生物医用高分子材料的研究. E-mail: jbyin@oa.shu.edu.cn
以聚 L-谷氨酸苄酯(PBLG)为原料, 通过溶剂浇铸与粒子沥滤法分别构建PBLG单层致密和PBLG单层多孔膜, 利用乙醇胺对薄膜表面改性, 构筑双层引导骨再生膜. 研究了不同胺解改性时间对PBLG-s-PHEG双层膜亲水性和力学性能的影响, 结果表明, 随着PBLG分子量的增大, 薄膜的力学性能增强而降解速率减缓. 延长胺解改性时间可提高薄膜亲水性和体内外降解速率. 细胞实验结果表明, 双层薄膜的致密结构能够有效阻隔成纤维细胞的侵入, 多孔结构能够支持细胞贴壁黏附和铺展. 体外生物活性评价结果表明, 表面改性的PBLG基材料可用于体内骨缺损修复. 本文所构建的双层引导骨再生膜在体外具有良好的力学性能和降解性能, 与组织具有一定的贴合性, 同时可有效阻碍成纤维细胞侵入, 具有潜在应用价值.
Guided bone regeneration film plays an important role in bone defect reconstruction. In this paper, poly( γ-benzyl- L-glutamate)(PBLG) was used as raw materials to construct dense films and porous films by solvent casting and particle leaching. And the bilayers guided bone regeneration membrane was constructed by ethanolamine amine membrane modification on the surface. The effect of different modification time on the hydrophilicity and mechanical properties of the films was investigated. The results show that with the increase of the molecular weight of PBLG, the mechanical strength of the film increases and the degradation rate is getting slower. Prolonging the time of amine modification can improve the hydrophilicity of the film and the degradation rate both in vivo and in vitro. Through cell experiments, it was found that the dense layer could effectively block the invasion of fibroblasts, and the porous layer can support adherence and spread of cells. Surface-modified PBLG-based materials were demonstrated to be useful for repair of bone defects in vivo by in vitro bioactivity evaluation. The guided bone regeneration membrane constructed has good mechanical properties, degradation performance, and a certain degree of fit with the tissue. And it could effectively inhibit the infiltration of fibroblasts. The membrane has potential application value.
1982年Nyman等[1]首次提出引导组织再生的概念, 由于引导骨再生膜具有优异的骨组织再生效果而备受关注. 引导骨再生膜通过屏蔽作用防止非成骨细胞向缺损区内侵入, 同时在薄膜的下方创造一个空间, 容许成骨细胞率先移动、 生长及增殖, 实现骨再生及修复的目的[2, 3].
目前引导骨再生膜研究进展十分迅速, 其制备材料主要有生物可降解的天然高分子和合成高分子[4]. 天然高分子(如胶原、 壳聚糖及其衍生物等)具有良好的生物相容性和可降解性. 但天然高分子作为引导骨再生膜的机械强度较弱, 手术操作时可能坍塌而无法为缺损区域提供一个稳定的再生空间[5, 6]. 合成高分子的优点是分子量可控且批次稳定, 材料具有良好的机械强度. 常见的合成高分子有聚乙交酯-丙交酯共聚物(PLGA)及聚乳酸(PLA)等, 但这类材料亲水性较差, 其薄膜与周围组织的贴合性不佳, 在体内降解过程中, PLA和PLGA的降解产物会造成区域性的微酸环境, 从而引起无菌性炎症反应[7]. 因此选择更适合的材料构建引导骨再生薄膜显得尤为重要[8]. 理想的引导骨再生膜具有良好的生物相容性、 一定的力学强度、 适当的空间结构及功能梯度[9, 10]. 此外, 作为植入缺损区域的薄膜, 要求其具有合适的降解速率和良好的亲水性, 并且薄膜能够与周围组织相互结合, 形成闭合空间[11].
聚L-谷氨酸苄酯(PBLG)是一种人工合成的聚多肽, 具有优良的生物相容性和低免疫原性及无毒副作用等优点[12, 13], 同时具有优异的细胞黏附和增殖能力[14, 15]. 由于PBLG亲水性差, 从而限制了其应用于引导骨再生膜.
本文通过PBLG与乙醇胺反应使PBLG疏水的部分苄基侧链被羟烷酰胺取代[16, 17], PBLG薄膜表面部分转化为聚羟乙谷氨酰胺(PBLG-s-PHEG), 构建具有致密结构和多孔结构的双层薄膜, 系统研究了PBLG的亲水性和体内外降解速率之间的关系. 同时对薄膜的微观形貌、 力学性能、 组织贴合性及体内外降解速率进行评价. 模拟细胞穿透薄膜的过程, 评价薄膜的屏蔽阻隔作用和细胞在薄膜上的黏附行为, 同时对薄膜的体外生物活性进行评价.
二氯甲烷、 1, 4-二氧六环、 二甲苯及乙醇胺均为分析纯, 阿拉丁试剂有限公司. 参照文献[18]方法, 由三乙胺(DCHA)引发N-羧酸酐L-谷氨酸苄酯(BLG-NCA)开环聚合制备PBLG.
Bruker AV 500 MHz核磁共振波谱(1H NMR)仪, 瑞士Bruker公司; FTIR-380型傅里叶变换红外光谱(FTIR)仪, 美国热电科技仪器有限公司; HITACHI SU-1500型钨灯丝扫描电子显微镜(SEM), 日本Hitachi公司; 日本力学电击株式会社; Waters 1515型凝胶渗透色谱(GPC)仪, 美国Waters公司; Q-800型动态热机械分析(DMA)仪, 美国TA公司; DXLL-10000型电子拉力试验机, 上海德杰仪器设备有限公司; DM2500 M型正置荧光显微镜, 德国Leica公司.
合成路线见Scheme 1. 通过溶剂浇铸/粒子沥滤法构建PBLG单层致密膜. 将0.4 g PBLG溶于20 mL二氯甲烷溶液中, 室温磁力搅拌1.5 h, 将溶液倒入聚四氟乙烯模具中, 室温挥发至恒重, 即得PBLG单层致密膜(PBLG-SDM). 将0.25 g PBLG溶于20 mL二氯甲烷溶液中, 将溶液倒入底部铺有6 g氯化钠(NaCl)固体的聚四氟乙烯模具中, 室温挥发至恒重后将含有NaCl的PBLG薄膜用去离子水浸洗后, 于37 ℃摇床内透析5 h, 透析完成后将多孔膜在通风处中室温干燥至恒重, 即得PBLG单层多孔膜(PBLG-SPM).
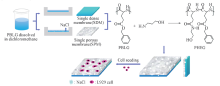 | Scheme 1 Fabrication of amine-modified PBLG guided bone regeneration film After cell seeding, the barrier function and biocompatibility of the membranes were evaluated. |
将PBLG-SDM和PBLG-SPM分别在25 mL乙醇胺溶液中浸泡9, 12和14 h, 即得胺解改性的单层致密膜(PBLG-s-PHEG-SDM)和单层多孔膜(PBLG-s-PHEG-SPM); 将改性后的单层膜用去离子水浸洗并真空干燥后待用.
配制1, 4-二氧六环和二甲苯的混合溶剂(体积比为100∶ 1), 作为双层膜的黏合剂, 将PBLG-s-PHEG-SDM铺在平整表面, 喷涂少量黏合剂, 再将PBLG-s-PHEG-SPM放在致密膜上, 用溶剂将两者复合; 将双层膜用去离子水浸洗干燥后即得胺解改性PBLG双层膜(PBLG-s-PHEG). 利用黏合剂制备的PBLG双层膜作为对照.
1.3.1 PBLG-s-PHEG-SDM 接触角测试 采用静滴法, 对不同胺解改性时长的薄膜进行接触角测试, 在室温下以3 μ L的进样量, 将去离子水滴加在薄膜的表面. 每个样品分别选取3个平行点, 计算平均值, 即为待测薄膜样品的接触角数值.
1.3.2 贴合性测试 在兔铙骨处构建15 mm× 2 mm× 4 mm的骨缺损区域, 将PBLG双层膜与PBLG-s-PHEG双层膜用去离子水润湿后覆盖在缺损区域, 观察双层膜与周围组织的贴合性并拍摄照片.
1.4.1 拉伸强度测试 参照文献[19]方法, 采用动态力学热分析仪分别对干态的PBLG-SDM, PBLG-SPM, PBLG双层膜和PBLG-s-PHEG双层膜进行拉伸强度测试. 试样尺寸为20 mm× 10 mm× 0.4 mm, 室温下拉伸速率为5 mm/min, 直至薄膜被破坏. 选取5个平行样品进行测试, 薄膜断裂时的强度即为拉伸强度.
1.4.2 缝合保留强度测试 参照文献[20, 21]方法, 采用电子拉力试验机分别对干态的PBLG-SDM, PBLG-SPM, PBLG双层膜和PBLG-s-PHEG双层膜进行缝合保留强度测试. 试样尺寸为20 mm× 10 mm× 0.4 mm, 试样一端夹在万能试验机夹具上; 将5-0的手术缝合线形成一个循环, 穿入距离样品自由末端2 mm的位置上, 室温下拉伸速率为120 mm/min , 直至薄膜被破坏. 选取5个平行样品进行测试, 缝合保留强度(Suture retention/MPa)根据下式计算:
式中: F(N)为最大应力; S(m2)为薄膜截面面积.
1.5.1 体外降解实验 参考文献[22]方法, 以磷酸盐缓冲液(PBS)为降解介质, 模拟体内pH环境, 测试PBLG双层膜和PBLG-s-PHEG双层膜体外降解性能. 将一定质量(md)的薄膜浸入3 mL 0.1 mol/L, pH=7.4的PBS缓冲溶液中, 置于37 ℃台式全温振荡器中, 振荡速率为60 r/min; 每48 h更换一次PBS缓冲溶液, 在预先设定的时间点取出薄膜, 用去离子水反复冲洗后缓慢振荡数次, 然后用滴管小心将瓶中上层PBS缓冲液吸出; 重复操作3次, 洗涤薄膜后冷冻干燥24 h, 称重(mi). 每个时间点测定3个平行样品, 取平均值. 参照下式计算双层膜剩余质量分数(w1, %):
1.5.2 体内降解实验 将PBLG-s-PHEG双层膜裁成20 mm× 20 mm大小, 用钴-60 γ 射线消毒后浸泡在PBS溶液中30 min, 再将其植入C57/b6小鼠背部皮下, 共使用12只老鼠, 每只小鼠植入2片薄膜材料; 分别于168, 2016和3024 h后取出植入的薄膜材料, 用4%多聚甲醛固定, 然后脱水, 用石蜡包埋, 切片, 用苏木精-伊红染色(HE染色), 用于SEM观察.
参照文献[23]方法, 构建检测薄膜的细胞屏障功能的装置(Scheme 2). 将L929细胞以4.0× 104 Cells/mL接种于经钴-60 γ 射线消毒后的检测装置上层, 置于37 ℃, 5% CO2培养箱中培养1, 3, 5, 7 d后将PBLG-s-PHEG双层膜或PBLG-s-PHEG-SPM取出; 用4%多聚甲醛固定8 h, 观察细胞与薄膜的形貌.
参照文献[24]方法, 采用1.5倍浓度的模拟体液(1.5× SBF)为浸泡液, 在PBLG-s-PHEG双层膜上矿化沉积羟基磷灰石(HA). 将胺解12 h并干燥的双层膜(样品尺寸: 20 mm× 10 mm)浸入35 mL 1.5× SBF浸泡液中, 然后置于37 ℃台式全温振荡器中, 振荡速率为60 r/min. 每天早晚各更换一次SBF溶液, 浸泡3, 7, 14 d后取出样品; 在预先设定的时间点取出PBLG-s-PHEG双层膜, 将浸泡液用去离子水反复冲洗后, 缓慢振荡数次, 然后用滴管小心将瓶中上层SBF溶液吸出; 重复操作3次, 洗净PBLG-s-PHEG双层膜; 将洗净后的薄膜冷冻干燥24 h, 得到干燥薄膜, 进行SEM观察, 同时对薄膜进行热重分析.
参照文献[18]方法, 通过改变引发剂与单体的比例, 制备出2种分子量的PBLG, 并使用凝胶渗透色谱(GPC)与黏度法测量产物的分子量, 结果如表1所示.
| Table 1 Molecular weight and distribution of PBLG with different molar ratio of monomer(A) and initiator(I) |
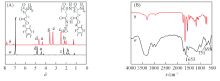
通过溶剂浇铸与粒子沥滤法构建PBLG单层膜. 将PBLG-SDM和PBLG-SPM在乙醇胺溶液中进行化学改性, 薄膜表面的苄基侧链部分取代为羟烷酰胺侧链, 薄膜表面转化为聚羟乙谷氨酰胺(PBLG-s-PHEG). 通过核磁共振波谱(1H NMR)与红外光谱(FTIR)对胺解改性前后双层膜的化学组成进行表征.
图1(A)给出PBLG和PBLG-s-PHEG双层膜的核磁共振波谱. 可见, δ 7.00处的吸收峰为PBLG重复单元中苯环(f)质子化学位移, δ 4.81处的吸收峰为PBLG重复单元中与苯环相连亚甲基(d)质子化学位移, δ 4.40处的吸收峰为PBLG主链中次甲基(a)质子化学位移, δ 2.18处的吸收峰归属于PBLG重复单元次甲基(c)质子化学位移, 而δ 1.68和1.87处的吸收峰为重复单元中和叔碳相连亚甲基(b)质子化学位移. PBLG-s-PHEG双层膜的核磁共振波谱中位于δ 7.00处苯环质子峰和δ 4.81处亚甲基质子峰减弱, 说明胺解能够将聚合物中侧链部分脱除. 同时δ 3.31和3.64处的信号峰则归属于乙醇胺上的亚甲基(e)和(g)化学位移.
图1(B)给出PBLG和PBLG-s-PHEG双层膜的的红外谱图. 1653和3300 cm-1处为酰胺基团特征吸收峰, 3065 cm-1处为苯环C— H伸缩振动吸收峰, 751 和698 cm-1处为苯环面外变形振动特征吸收峰. 对比谱线a和b可以看出, 苯环的特征峰依然存在, 3000~3500 cm-1处出现峰形相对较宽的峰, 这是聚合物的羟烷酰胺侧链中羟基特征峰.
引导骨再生膜作为界面植入物, 其与结缔组织和骨组织接触, 需要利用自身的结构, 满足局部功能的需求[2]. 引导骨再生膜的致密结构需能够阻隔周围结缔组织, 避免纤维组织侵入骨缺损处; 而多孔层可以提高细胞黏附, 稳定凝血块, 有骨生成能力的细胞缓慢进入缺损区完成再生[25].
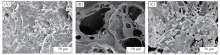
图2给出PBLG-s-PHEG-SDM, PBLG-s-PHEG-SPM和PBLG-s-PHEG双层膜的表面及截面结构的SEM照片, 同时对薄膜厚度进行测量. 由图2(A1)和(A2)可见, PBLG-s-PHEG-SDM表面光滑且没有孔隙, 厚度在100~130 μ m之间. 由图2(B1)和(B2)可见, 通过溶剂浇铸/粒子沥滤法制备的PBLG-s-PHEG-SPM孔径为200~400 μ m. 与PBLG-s-PHEG-SDM相比, PBLG-s-PHEG-SPM比表面积更大, 有利于聚合物与体液接触, 同时孔隙的贯通性有利于营养液及细胞代谢产物的交换. PBLG-s-PHEG-SPM具有粗糙的表面, 因此有利于细胞的成骨分化[26]. PBLG-s-PHEG-SDM厚度在280~320 μ m之间. 图3(A)给出PBLG-s-PHEG双层膜的截面SEM照片. 图3(B)为3种薄膜的厚度比较. 由图3(A)可见一层为致密结构, 表面光滑, 没有孔隙; 另一层为多孔结构, 具有一定贯通的孔隙, 2层紧密复合, PBLG-s-PHEG双层膜厚度在360~400 μ m之间.
 | Fig.2 SEM images of the sarface(A1, B1) and cross-section(A2, B2) of PBLG-s-PHEG-SDM(A1, A2) and PBLG-s-PHEG-SPM(B1, B2) |
薄膜需要为缺损区域提供一个稳定的力学支撑, 作为机械屏障保护凝血块和孤立骨缺损周围的结缔组织, 因此薄膜必须具有一定的强度[27]. 作为植入物, 薄膜在缝合过程中需要具有一定缝合保留强度来保证缝合的顺利完成. 通过DMA与电子拉力试验机分别测定了PBLG-SDM, PBLG-SPM, PBLG双层膜和PBLG-s-PHEG双层膜的拉伸强度和缝合保留强度.
图4(A)和(B)给出不同分子量的薄膜的拉伸强度与缝合保留强度. 薄膜的拉伸强度与PBLG的分子量和固含量有关: 随着分子量的增大, PBLG-SDM的拉伸强度由2.9 MPa提高至12.4 MPa, 拉伸强度显著提升. 由于PBLG-SDM的固含量小于PBLG-SPM, 因此力学性能明显下降, 如黏均分子量(Mη )为8× 104的PBLG-SPM拉伸强度仅为0.06 MPa, 远远小于同等分子量致密膜的拉伸强度. PBLG双层膜的拉伸强度与单层致密膜没有明显变化, 可见, 在双层膜的整体结构中, 单层致密膜起到力学支撑的作用.
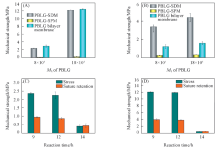 | Fig.4 Mechanical strength of PBLG-s-PHEG membranes with different Mη of PBLG and different reaction time (A) Tensile strength; (B) suture retention strength. Mη of PBLG: (C) 8× 104; (D) 18× 104. |
由图4(C)和(D)可见, 当胺解改性时间超过12 h, PBLG-s-PHEG双层膜的力学性能显著下降. 黏均分子量为8× 104和18× 104时, 拉伸强度分别由2.3和12.4 MPa下降至0.4和0.48 MPa, 下降约87%和96%. 薄膜表面发生胺解反应, PBLG的苄基侧链转化为羟烷酰胺侧链. 在反应开始时, 由于PBLG薄膜为疏水薄膜, 表面与乙醇胺溶液的亲和性很小, 胺解反应进行十分缓慢. 反应超过一定时间后, 表面的羟烷酰胺侧链使薄膜表面的亲水性提升, 反应速率加快. 随着浸泡时间的延长薄膜表面不断被溶蚀, 当反应时间超过12 h后, 薄膜表面开始出现孔洞, 拉伸测试的过程中易出现应力集中, 因此拉伸强度明显下降.
引导骨再生膜被植入缺损区域后, 不能陷入缺损区域, 否则将会影响修复效果[28], 但如果薄膜的韧性过强, 植入后边缘部分可能会伤害到周围的组织, 尤其是在口腔内狭小的环境内, 通常会导致并发症, 因此本文选取胺解改性12 h的PBLG-s-PHEG双层膜与初始薄膜进行比较, PBLG黏均分子量为8× 104的PBLG-S-PHEG双层膜拉伸强度下降了约20%, 缝合保留强度下降了约25%. 但薄膜仍具有一定机械强度, 能为缺损区域在修复期间提供一个稳定的力学支撑[29]. PBLG黏均分子量为18× 104的PBLG-s-PHEG双层膜的拉伸强度下降了约5%.
在缺损区域的修复过程中, 引导骨再生膜需要与周围组织相互整合, 形成闭合空间, 防止纤维组织侵入[11], 构建引导骨再生膜必须考虑薄膜的亲水性. 同时PBLG内部主链通过肽键结合, 侧链则通过酯键结合, 聚合物降解行为主要是水解. 因此通过调控薄膜表面的亲水性, 使制备的双层膜在生物体内具有合适的降解速率. 通过对PBLG单层致密膜的表面接触角进行测试, 评价薄膜的亲水性.
由图5可见, 2种分子量的单层致密膜的接触角分别为80° ~82° 和115° ~120° , 分子量小的薄膜接触角小, 初始亲水性能更佳. 随着致密膜在乙醇胺溶液中反应时间的增加, 2个分子量的薄膜接触角数值分别由80° 和115° 下降至50° 和62° . 随着反应时间的增加, 接触角数值逐渐减小, 薄膜亲水性提升. 证明通过胺解能够使薄膜表面更加亲水.
 | Fig.5 Variation of the contact angle of the PBLG membranes with different Mη and reacton time Mη of PBLG: (A) 8× 104; (B) 18× 104. |
为验证双层膜与周围组织的贴合性, 将PBLG双层膜和PBLG-s-PHEG双层膜分别覆盖在兔铙骨缺损模型上. 由图6可知, 覆盖薄膜后, PBLG双层膜与周围组织贴合性不佳, 薄膜边缘翘起, 而PBLG-s-PHEG双层膜与周围组织紧密贴合, 能够促使伤口边缘稳定, 同时骨骼和材料之间紧密贴合, 能够防止纤维结缔组织侵入到缺损部位.
2.5.1 胺解改性PBLG双层膜的体外降解 引导骨再生膜的降解速率颇为重要, 必须具有合适的降解速率. 理想的降解速率应与骨缺损新骨的长出速率相匹配, 即伤口部位愈合时, 材料基本降解.
图7为PBLG双层膜与改性12 h后PBLG-s-PHEG双层膜在PBS缓冲液中的降解曲线. 由图7可知, 经过126 d体外降解后, 薄膜均有不同程度的失重, 失重率也随着降解时间延长而增加. PBLG-s-PHEG双层膜的降解速率比PBLG双层膜的降解速率快. 这是由于PBLG的侧链为苄基, 为疏水基团, PBLG降解过程均为水解反应[13], 因此PBLG双层膜的降解速率缓慢, 失重率较小. 经过表面改性, 薄膜表面亲水性有了较大提升, 聚合物的降解速率加快. 经过126 d体外降解, 黏均分子量为8× 104的双层膜在改性12 h后的最大失重率为41.01%, 黏均分子量为18× 104的失重率为15%. 比较二者的失重率, 可知选取分子量较小的聚合物能够加快降解速率.
 | Fig.7 In vitro degradation of PBLG bilayer membrances(a) and PBLG-s-PHEG membranes(b) with different reacting time and Mn of PBLG in PBS solution Mn of PBLG: (A) 8× 104; (B) 18× 104. |
图8给出PBLG-s-PHEG双层膜体外降解的SEM照片. 由图8(A1)可知, PBLG-s-PHEG双层膜的致密结构在降解7 d后表面仍然保持光滑. 随着降解时间的延长, 致密结构表面出现裂痕. 经过126 d后, 致密结构表面裂痕变大, 降解液内有薄膜小块碎片. 多孔结构在降解7 d后, 形貌保持完整, 孔径尺寸维持不变, 孔壁上存在许多密集小孔. 由图8(B2)可见, 随着降解时间延长, 孔壁发生断裂, 三维结构开始坍塌, 说明已发生明显降解, 孔壁上的密集小孔尺寸变大. 图8(B3)为多孔结构降解126 d后SEM照片, 可见薄膜上部分孔壁已经降解, 孔径尺寸增加, 薄膜整体也瓦解为若干碎片.
 | Fig.8 SEM images of PBLG-s-PHEG membranes in vitro degradation with PBLG-s-PHEG-SDM membrane(A1— A3) and PBLG-s-PHEG-SPM membrane(B1— B3) at 7 d(A1, B1), 84 d(A2, B2) and 126 d(A3, B3) |
2.5.2 PBLG-s-PHEG双层膜的体内降解 在体外降解实验中, PBLG-s-PHEG双层膜具有生物可降解性, 薄膜材料体外降解依赖材料表面的溶蚀和聚合物水解, 而在生物体内的降解还会受到生物活性物质的影响, 其降解是在化学和生物的共同作用下进行的[30, 31]. 将PBLG黏均分子量为8× 104的PBLG-s-PHEG双层膜植入C57小黑鼠背部, 研究材料的体内降解情况.
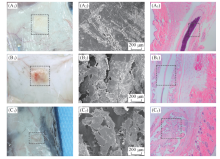 | Fig.9 In vivo degradation of the PBLG-s-PHEG membranes with 7 d(A1— A3), 84 d(B1— B3) and 126 d(C1— C3) (A1— C1) Cross appearance images; (A2— C2) SEM images; (A3— C3) H& E images. |
图9给出PBLG-s-PHEG双层膜皮下植入C57小黑鼠背部的SEM照片和H& E染色图. 由图9可见, 皮下植入7 d, 薄膜的形态和结构仍保持完整, 但表面覆盖体内组织. 可以看到皮下植入7 d后双层薄膜致密结构表面出现细微裂痕. 由H& E染色图可以看到薄膜表面出现纤维囊包裹.
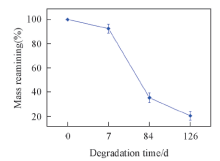 | Fig.10 Degradation of mass change of the PBLG-s-PHEG member with Mη of PBLG of 8× 104 and reaction time of 12 h in vivo |
皮下植入84 d, 薄膜尺寸明显变小[图9(B1)], 孔道出现坍塌现象, 致密层已部分瓦解. 由图9(B3)可知, 未降解薄膜与小鼠体内组织结合在一起, 但依然出现纤维囊包裹. 当皮下植入126 d后, 小鼠体内仅剩少量残留材料, PBLG-s-PHEG双层膜降解成许多碎片. 通过H& E染色可以看出, 体内未降解材料与小鼠体内组织紧密结合在一起.
将植入小鼠体内的薄膜取出后脱去组织, 漂洗并干燥后进行称重(图10). 与体外降解失重曲线相比, 薄膜在生物体内的降解受到环境与活性物质的影响, 降解速率加快: 经过126 d体内降解, 失重率为83%, 远高于体外降解41.01%的失重率.
引导骨再生膜作为物理机械屏障需要阻挡周围结缔组织长入缺损区; 因此要求能够阻碍成纤维细胞进入缺损区域, 阻碍骨修复进程[32]. 参照文献[33]方法, L929细胞为小鼠成纤维细胞, 本文通过Scheme 2所示装置模拟细胞穿透薄膜的过程, 分别对黏均分子量为8× 104, 胺解改性12 h后的单层多孔膜与双层膜进行细胞培养实验, 结果见图11.
由图11(A)可见, 将L929细胞接种于PBLG-s-PHEG双层膜致密结构表面, 经过5 d培养, 观察发现细胞黏附在致密层, 而多孔结构表面没有贴壁细胞及细胞外基质. 说明双层膜中的致密结构能够有效阻碍细胞穿透薄膜, 为缺损修复提供空间. 在体内修复过程中, 若成纤维细胞穿过薄膜进入缺损区域, 会形成纤维组织阻碍修复进程. 因此作为机械屏障, 薄膜需阻碍细胞进入缺损区域[33]. 结果表明本文构建的薄膜具有良好的屏障作用.
由图11(B)可见, 当L929细胞接种于PBLG-s-PHEG-SPM表面, 细胞在多孔表面铺展分泌细胞外基质, 细胞分布在孔隙内外, 沿着多孔层结构生长, 说明单层多孔薄膜不能阻碍细胞侵入. 但可以证明表面改性的PBLG多孔层的三维多孔结构可为修复组织生长提供充分的空间.
细胞培养实验证明, PBLG-s-PHEG双层膜能够有效阻碍成纤维细胞进入缺损区域, 屏障性能优异, 同时多孔膜可支持细胞黏附与侵入, 在引导骨再生领域具有应用潜力.
将材料浸泡于模拟体液中进行矿化, 表面HA生长能力是用来评价材料成骨活性的体外方法[34, 35]. 由模拟体液仿生法矿化获得 HA, 反应条件温和(37 ℃), 不受基体材料形状限制. 因此本文选择孔结构贯通的双层引导骨再生膜, 将其浸泡在 1.5× SBF 中以评价材料的骨诱导作用.
图12给出PBLG-s-PHEG双层膜在SBF溶液中浸泡时间为0, 3, 7和14 d 时, 材料表面HA矿化生长情况. 由图12(A)可见, 在浸泡之前, 薄膜表面无颗粒状HA, 孔结构贯通. 将薄膜浸泡在SBF溶液3 d后, 多孔结构孔壁上附着有少量白色颗粒状HA[图12(B)]. 随着浸泡时间的增加, 薄膜表面颗粒的数量增多, 但颗粒大小不均匀. 当浸泡时间为 14 d 时[图12(D)], 薄膜孔壁上球形颗粒密度较高. 可见, 在薄膜表面, 随着浸泡时间延长, 矿化HA的数量逐渐增多.
 | Fig.12 SEM images of the growth of HA on the surface of PBLG-s-PHEG bilayer membranes in SBF solution Time/d: (A) 0; (B) 3; (C) 7; (D) 14. |
图13给出不同矿化时间的薄膜的热重分析结果. 可知胺解后双层膜的分解温度在310 ℃ 左右. 随着矿化时间的增加, 薄膜的失重率在逐渐减小. PBLG-s-PHEG双层膜经过矿化0, 3, 7和14 d时的失重率分别为92%, 88%, 84%和79%. 热重结果说明, 随着浸泡时间的延长, HA的沉积量逐渐增加.
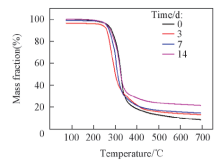 | Fig.13 Thermogravimetric curve of amine-modified PBLG bilayer membranes in SBF solution with different time |
体外模拟体液中材料的 HA 生长能力可以用来预测和评估材料在体内的成骨能力[34, 35], 以上结果证实了表面改性的PBLG基材料可用于体内骨缺损修复.
以PBLG为原料, 通过溶剂浇铸/粒子沥滤法制备具有不对称多孔阻隔结构的双层膜. 通过乙醇胺溶液对薄膜进行表面改性, 使薄膜表面更加亲水, 但同时力学性能减弱. 体外和体内降解实验结果表明, 通过调节薄膜表面亲水性, 可提高材料降解速率. 薄膜细胞培养实验结果表明, PBLG双层膜能有效阻隔成纤维细胞的侵入, 为缺损区域修复提供稳定的修复环境, 多孔层可支持细胞黏附铺展. 同时薄膜具有良好的生物相容性和稳定性, 在体外可诱导矿化沉积HA, 在引导骨再生薄膜领域具有潜在的应用价值.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|