联系人简介: 张克杰, 女, 博士, 副教授, 主要从事无机纳米复合材料研究. E-mail: zhangkejie2003@163.com
以乙酸镉、 2-巯基苯并噻唑、 硫化钠和氯化铜为原料, 依次利用液相热分解与离子吸附法, 改变CdS晶化时间及含量, 制备了4种CdS/CuS纳米复合材料. 研究结果表明: CdS/CuS纳米复合材料呈类球形核壳结构, 改变CdS晶化时间可以控制CdS/CuS纳米复合材料粒径大小; CdS的晶化时间为10 min, CdS与CuS摩尔比为4∶1的纳米复合材料光催化活性最佳, 25 min内对RhB和MB的降解效率均达到99%.
Four CdS/CuS core-shell nanocomposite samples with different molar ratios of CdS to CuS were synthesized via liquid-phase thermal decomposition and ion adsorption method under different crystallization time of CdS, using cadmium acetate, 2-mercaptobenzothiazole, sodium sulfide and cupric chloride as the raw materials. The experimental results indicated that the samples were spherical nucleus-like structures and their particle size was controllable with the crystallization time of CdS. The degradation efficiencies of rhodamine B(RhB) and methylene blue(MB) both reached about 99% when the molar ratio of CdS to CuS was 4∶1 and the crystallization time of CdS was 10 min. The method of ion adsorption makes CuS fully coat on the surface of CdS, forming effective core-shell structure and obviously improving the photocatalytic performance of CdS.
近年来, 环境与能源问题日益严峻, 简单、 有效且环保地处理污水中的有机污染物是材料学界研究的重要课题之一. 以太阳能作为直接驱动力的光催化技术以其低成本、 无污染且高效率的特点受到广泛关注[1, 2].
金属硫化物具有良好的非线性光学性质[3]、 光催化活性[4]和光电转换性能[5], 被广泛应用于光催化合成[6, 7]、 光降解有机污染物[8, 9, 10]、 光分解水制氢[11, 12, 13]及光催化还原C
本文采用乙酸镉、 2-巯基苯并噻唑、 硫化钠和氯化铜为原料, 通过简单的液相热分解和离子交换法合成了颗粒尺寸可控的CdS/CuS纳米复合材料, 对样品的结构和组成进行了表征, 并对样品的光催化性能进行了研究.
二水合乙酸镉(分析纯)、 二水合氯化铜(分析纯)和2-巯基苯丙噻唑(HMBT, 纯度98%)购于阿拉丁试剂有限公司; 无水乙醇和九水合硫化钠(分析纯)购于无锡市亚盛化工有限公司; 油酸(化学纯)购于上海凌峰化学试剂有限公司.
Thermo ESCALAB 250xi型X射线光电子能谱仪(XPS, 日本岛津公司, 工作电压15 kV, 工作电流10 mA, Al Kα 射线); Ultima-Ⅳ 型X射线衍射仪(XRD, 日本理学株式会社, 工作电压40 kV, 工作电流40 mA, Cu Kα 射线); JSM6360LVX型扫描电子显微镜(SEM, 日本理学株式会社); JEOL-2100型透射电子显微镜(TEM, 日本电子株式会社); UV-3900型固体紫外-可见漫反射光谱仪(日立高新技术公司); UV-1800型紫外-可见分光光度计(日本岛津公司).
1.2.1 Cd(MBT)2的制备 将1.581 g 二水合乙酸镉和1.984 g HMBT固体颗粒分别置于含有80 mL和50 mL无水乙醇溶液的烧杯中, 充分搅拌使其溶解, 然后将2种溶解后的液体混合, 立刻出现淡黄色沉淀, 将该沉淀抽滤、 洗涤、 烘干, 即得到淡黄色粉末状Cd(MBT)2.
1.2.2 CdS纳米颗粒的制备 采用液相热分解的方法[38, 39]制备CdS固体颗粒. 将2.639 g Cd(MBT)2加入盛有160 mL油酸的三颈烧瓶中, 以回流、 搅拌的方式持续加热, 温度达到150 ℃时Cd(MBT)2粉末全部溶解, 溶液呈橙红色, 继续加热, 当温度达到290 ℃时出现橙黄色沉淀, 恒温反应10 min后冷却至室温, 将所得悬浊液离心, 并用无水乙醇和去离子水洗涤, 烘干后得到CdS(10 min) 纳米颗粒. 改变恒温反应时间, 以相同的方法制备晶化1 h的 CdS(1 h) 纳米颗粒.
1.2.3 CdS/CuS纳米复合材料的制备 采用S2-吸附的方法制备CdS/CuS复合纳米材料. 将0.858 g CdS(10 min)纳米颗粒分散在装有适量饱和Na2S溶液的烧杯中, 水浴加热并持续搅拌20 min, 然后将所得悬浊液离心并用去离子水洗涤, 即得到被硫离子包附的CdS颗粒. 再将所制备的颗粒分散到去离子水中进行水浴加热、 搅拌. 另外称量0.253 g二水合氯化铜固体溶于装有少量去离子水的烧杯中, 形成CuCl2溶液. 将CuCl2溶液滴入硫离子包附的CdS溶液中, 充分反应5 min后, 将所得的溶液离心, 洗涤、 烘干沉淀, 即得到CdS(10 min)与CuS摩尔比为4∶ 1的纳米复合材料, 记为CdS(10 min)/CuS(4∶ 1). 以CdS(1 h)纳米颗粒为核, 采用相同的方法制备CdS(1 h)/CuS(4∶ 1)纳米复合材料.
以CdS(10 min) 纳米颗粒为核, 采用相同的方法分别制备CdS(10 min)/CuS(3∶ 1), CdS(10 min)/CuS(5∶ 1) 纳米复合材料.
1.2.4 光催化实验 样品的光催化性能通过在室温下光降解0.01 g/L的罗丹明B(RhB)、 亚甲基蓝(MB)和甲基橙(MO)染料进行评价. 光降解的操作步骤参见文献[40]. 在暗室下搅拌20 min后取样, 再以Hg灯作为光源, 每隔5 min取10 mL光催化后的悬浊液, 高速离心. RhB和MB溶液的浓度通过紫外-可见分光光度计分别在波长552 nm和662 nm处的吸光度计算.
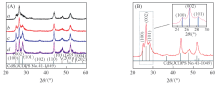
图1(A)为所合成的4种CdS/CuS纳米复合材料的XRD谱图. 图1(A)中样品晶面(100), (002), (101), (110), (103), (112)的衍射峰与六方纤锌矿构型CdS的标准卡片(JCPDS No. 41-1049)基本一致. 说明该方法制备的纳米复合材料中CdS为六方纤锌矿构型. 谱图中并没有出现CuS的特征峰. 图1(B)中样品CdS(10 min)/CuS(4∶ 1)的谱图中部分衍射峰位置与标准卡片相比有轻微的偏移, 其中(100)晶面的2θ 向大角度偏移了0.293° , (002)晶面的2θ 向大角度偏移了0.013° , (101)晶面2θ 向大角度偏移了0.118° , 这可能是由于CuS与CdS形成复合物使CdS的晶体生长发生改变, 从侧面证明所制备的样品中含有CuS, 亦说明CuS与CdS并不是简单的机械混合, 而是形成了CdS/CuS纳米复合物.
图2为CdS(10 min)/CuS(3∶ 1)及CdS(10 min)/CuS(4∶ 1)纳米复合材料和纯CdS的XPS全谱图及Cd, Cu, S自旋-轨道分裂谱图分峰拟合图.
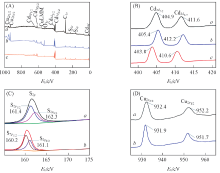 | Fig.2 XPS spectra of CdS(10 min)/CuS(4∶ 1)(a), CdS(10 min)/CuS(3∶ 1)(b) and pure CdS(c) (A) Full spectrum; (B) Cd3d; (C) S2p; (D) Cu2p. |
由图2(A)可见, 样品的XPS谱中出现了Cd, Cu, S, C和O元素的峰, 其中O峰可能是由于样品从空气中吸附的O2和H2O而产生的[41]. 图2(B)为Cd3d的XPS谱图, 从图中可知CdS(10 min)/CuS(3∶ 1)的C
图3为不同CdS/CuS样品的SEM照片. 由图可知, 样品的形貌均为类球形, 粒径大小为15~25 nm. 比较图3(A)和(B)可知, 随着CdS晶化时间的延长, 颗粒粒径增大. 因此, 通过控制CdS的晶化时间可以控制样品的粒径大小. 比较图3(A), (C)和(D)可以看出, 3种样品的粒径大小及形貌基本不变, 表明CdS的相对含量对于复合材料的颗粒大小及形状基本没有影响. SEM分析结果表明, 复合物的颗粒大小主要由CdS的晶化时间决定.
图4为CdS(10 min)/CuS(4∶ 1)的TEM照片. 从图4(A)中可以看出, 样品粒径主要分布在15~25 nm之间, 这与SEM观测结果一致. 图4(B)是样品的高分辨率TEM照片, 从图中可以观察到清晰的CdS和CuS晶格条纹, 这说明样品具有良好的结晶度. 此外, 从图4(B)中可以观察到不规则的核壳结构(红色虚线内的是CdS, 黄色虚线与红色虚线之间的是CuS), 且CuS不是均匀地覆盖在CdS表面. 结合XRD和XPS的分析结果, 进一步确定了制备出的样品为CdS/CuS纳米复合结构.
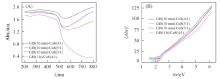
图5为样品的紫外-可见吸收光谱和能带间隙图. 由图5(A)可知, 所制备的CdS/CuS样品在紫外光和可见光区域均有响应能力, 表明其光吸收效率较高, 可在自然光下进行反应. 在CdS晶化时间为10 min的CdS(10 min)/CuS(3∶ 1), CdS(10 min)/CuS(4∶ 1)和CdS(10 min)/CuS(5∶ 1)3个样品中, CdS(10 min)/CuS(4∶ 1)对光的响应能力最强. 随着CdS晶化时间的延长, 样品颗粒变大, 但图5(A)表明晶化1 h的样品光学吸收性能明显下降, 并不利于光催化性能的提高. 如图5(B)所示, 利用Tauc plot曲线得到不同样品的能带间隙图, 通过外推法求得样品的禁带宽度. CdS(10 min)/CuS(3∶ 1), CdS(10 min)/CuS(4∶ 1)和CdS(10 min)/CuS(5∶ 1) 3个样品的禁带宽度分别为2.09, 1.67, 2.14 eV, CdS(1 h)/CuS(4∶ 1)禁带宽度为2.25 eV. 纯CdS的禁带宽度为2.42 eV, CdS与CuS的复合使样品的禁带宽度变窄, 有利于提高其光利用效率.
通过所制备样品在紫外光照射下降解RhB来考察CdS晶化时间为10 min的3个样品的光催化活性, 如图6所示. 图6(A)表明, 3种样品对RhB的降解效率明显高于纯CdS, 且不同样品表现出不同的降解效率. 光照时间5 min时, CdS(10 min)/CuS(5∶ 1)降解效率最高, 达到79.7%; 光照时间达到15 min时, CdS(10 min)/CuS(5∶ 1)降解效率达到94%, CdS(10 min)/CuS(4∶ 1)达到95%; 在光照25 min时, CdS(10 min)/CuS(4∶ 1)降解效率最高, 为99.1%, CdS(10 min)/CuS(3∶ 1)和CdS(10 min)/CuS(5∶ 1)分别为96.4%和95.6%, 说明CdS/CuS复合材料均具有优异的光催化活性. 图6(B)是不同样品降解RhB的一级反应动力学曲线. 如图所示, CdS(10 min)/CuS(4∶ 1) 斜率最大, 表明其降解速率最高. 可见, 无论从反应速率还是降解程度来看, 4个样品中, CdS(10 min)/CuS(4∶ 1)的光催化性能最佳.
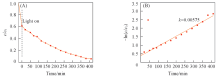
图7为CdS不同晶化时间的CdS/CuS(4∶ 1) 样品光催化降解MB的结果和一级动力学曲线图. 如图7(A)所示, CdS(10 min)/CuS(4∶ 1)在光照20 min时对MB的降解率为98.9%, 而在40 min时高达99.8%, 说明晶化时间为10 min的CdS/CuS(4∶ 1)对于MB也有优异的催化效果. 而晶化1 h的样品在光照20 min时, MB降解率只达到61.9%, 在光照40 min时MB降解率也仅仅到达70%, 表明CdS(10 min)/CuS(4∶ 1)的催化效果更好. 由图7(B)可知, CdS(10 min)/CuS(4∶ 1)对MB的降解速率明显比CdS(1 h)/CuS(4∶ 1)的快, 进一步表明CdS晶化时间的延长使样品的光催化活性减弱, 可能的原因是CdS晶化时间延长导致样品粒径增大, 比表面积减小, 故对MB的吸附效率降低.
图8为CdS(10 min)/CuS(4∶ 1)光催化降解甲基橙的结果和一级动力学曲线图. 在光照290 min时, MO的降解率达到86.2%; 在光照410 min时, 其降解率达到94.2%. 而文献[49]中采用共沉淀法制备的CuS/CuS复合材料在光照300 min后, MO的降解率仍未达到80%, 因此证明本文制备的CdS(10 min)/CuS(4∶ 1)复合材料的光催化性能优于文献报道.
样品光降解效率的柱状图(图9)表明, 以CdS(10 min)/CuS(4∶ 1)作为光催化剂时RhB和MB在光照25 min时降解率均达到99%, 说明所制备的样品光催化性能优异[6, 50]且具有广普性, 能够降解多种染料. 文献结果表明, 利用水热法制备Cu2+掺杂的CdS样品在240 min时MB的降解效率仅达到95.5%[51], 利用壳层硫化与岩心分离相结合的方法制备的核壳结构的Cu/CuS在200 min时对MB的降解率为90%[52], 表明本文制备的CdS(10 min)/CuS(4∶ 1)样品具有优异的光催化活性.
光催化降解低浓度有机污染物的反应为多相表面反应过程, 其动力学可以用Langmuir-Hinshewood(L-H)模型的一级简化形式描述:
式中: c(mol/L)为随时间变化的有机污染物浓度; c0(mol/L)为有机污染物的初始浓度; k为一级动力学常数; t(min)为反应时间[53]; b为常数项. 表1为不同样品降解染料的动力学方程. 从表中数据可以看出, CdS(10 min)/CuS(4∶ 1) 样品为光催化剂的反应动力学模型线性相关性较高, 因而该催化降解反应符合一级动力学反应. 比较5个样品的动力学方程可以看出, CdS(10 min)/CuS(4∶ 1)样品反应动力学模型的降解速率最大, 具有良好的光催化活性.
| Table 1 Kinetic equation of dyes degradation by different photocatalysts |
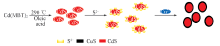
2.7.1 形成机理 Scheme 1示出了以Cd(MBT)2为前驱体, 制备CdS/CuS核壳结构复合材料的过程. Cd(MBT)2首先在油酸中通过热分解形成CdS纳米颗粒; 然后将CdS纳米颗粒均匀分散到饱和Na2S溶液中, 使CdS颗粒表面充分吸附S2-; 最后加入定量的CuCl2溶液, CdS表面吸附的S2-与Cu2+反应, 形成CdS/CuS核壳结构纳米复合材料.
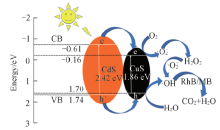
2.7.2 光催化降解机理 图10是CdS/CuS复合材料在光照下对有机染料RhB和MB的分解机理. CdS的禁带宽度为2.42 eV[54], CuS的禁带宽度为1.86 eV[55], 在光照下, CdS和CuS的导带均会产生光生电子(e-), 由于CuS的导带位置比CdS的导带位置低, 在内建电场作用下, CdS导带上的光生电子会转移到CuS的导带上. 光生电子与吸附在CdS/CuS纳米颗粒上的O2反应生成超氧自由基(·
将一步液相热分解与离子吸附法相结合, 制备出系列CdS/CuS纳米复合材料, 并研究了CdS的晶化时间和含量对CdS/CuS纳米复合材料光催化性能的影响. 结果表明, 延长 CdS 的晶化时间, CdS/CuS的晶粒粒径变大, 但光催化活性降低; 用晶化10 min的CdS制备的CdS/CuS(摩尔比为4∶ 1)的复合材料光催化活性最高, 25 min内对RhB与MB的降解率都达到99%, 在水污染的治理上有潜在应用价值.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|





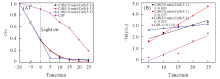
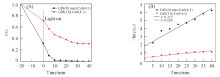

 CdS(1 h)/CuS(4∶ 1), MB;
CdS(1 h)/CuS(4∶ 1), MB;  CdS(10 min)/CuS(3∶ 1), RhB;
CdS(10 min)/CuS(3∶ 1), RhB;  CdS(10 min)/CuS(5∶ 1), RhB;
CdS(10 min)/CuS(5∶ 1), RhB;  CdS(10 min)/CuS(4∶ 1), RhB;
CdS(10 min)/CuS(4∶ 1), RhB;  CdS(10 min)/CuS(4∶ 1), MB. (B) a. CdS(10 min)/CuS(3∶ 1), RhB; b. CdS(10 min)/CuS(5∶ 1), RhB; c. CdS(10 min)/CuS(4∶ 1), RhB; d. CdS(10 min)/CuS(4∶ 1), MB; e. CdS(1 h)/CuS(4∶ 1), MB.
CdS(10 min)/CuS(4∶ 1), MB. (B) a. CdS(10 min)/CuS(3∶ 1), RhB; b. CdS(10 min)/CuS(5∶ 1), RhB; c. CdS(10 min)/CuS(4∶ 1), RhB; d. CdS(10 min)/CuS(4∶ 1), MB; e. CdS(1 h)/CuS(4∶ 1), MB.