联系人简介: 姚寿广, 男, 博士, 教授, 主要从事液流电池及其系统应用研究. E-mail: zjyaosg@126.com
研究了在流动的高浓度锌酸钾溶液中锡酸钾添加剂对锌负极沉积/溶解行为的影响. 循环伏安测试结果表明, 扫描速度为1 mV/s时, 随着添加锡酸钾浓度的增加, 阴极分支更早出现沉积, 溶解峰的峰值逐渐减小; 随着扫描速度的增加, 这种规律变得不明显. 利用SEM观测电沉积500 s的沉积物形貌发现, 向基础溶液中添加锡酸钾有利于晶种的产生和晶粒的生长. EDS测试结果表明含锡酸钾的锌酸钾溶液中沉积层含有锌和锡. 自放电测试结果表明, 基础电解液加入锡酸钾后自放电现象得到了明显的改善, 充满电静置12 h后加入0.1 mol/L锡酸钾的电池放电库仑效率从基础溶液的60.0%提高到81.1%.
The effect of potassium stannate additive on the deposition/dissolution behavior of zinc anode in flowing high concentration potassium zincate solution was studied. Cyclic voltammetry results show that when the scanning speed is 1 mV/s, the cathode branch deposits earlier with the increase of potassium stannate concentration, that is, the co-deposition of tin and zinc leads to the gradual decrease of dissolution peak with the increase of potassium stannate concentration. With the increase of scanning speed, the law becomes less obvious. SEM analysis shows that the addition of potassium stannate to the base solution is beneficial to seed production and grain growth. EDS tests show that the deposit from potassium stannate solution containing potassium stannate do contain zinc and tin. The self-discharge test shows that the self-discharge phenomenon is improved obviously after adding potassium stannate to the basic electrolyte. The Coulomb efficiency of the battery with 0.1 mol/L potassium stannate is increased from 60.0% of the basic solution to 81.1% after 12 h static charge. Therefore, the addition of potassium stannate in high concentration potassium zincate solution can benefit the production of seed and the growth of grain, produce compact small grains, make the deposit surface smoother and more compact, slow down the self-dissolution of zinc to a certain extent, and thus inhibiting the self-discharge effect.
锌电极具有资源丰富、 平衡电位低、 可逆性好、 能量密度高和无环境污染等优异性能, 在化学电源尤其是碱性锌系列电池中被广泛应用[1, 2, 3, 4], 但是锌电极在充放电过程中易发生形成枝晶、 钝化、 腐蚀、 电极形变以及自放电严重等问题[5], 使电池容量衰减, 循环性能下降.
目前, 人们通过加入电极添加剂以及改变电解液组分等方法来改善传统碱性电池中锌电极[6, 7]的电化学性能, 如向锌负极中加入In2O3, Bi2O3, SnO和Ca(OH)2等无机缓蚀剂[8, 9]能够促进锌的均匀沉积, 缓解锌电极的形变; 季铵盐类[10, 11, 12]和含氟表面活性剂[13]等电解液添加剂能够有效地抑制电极钝化, 缓解枝晶的生长, 但锌负极存在的问题目前依然没有得到很好的解决.
锌镍单液流电池采用常规流动的电解液提高了库仑效率, 减轻了枝晶, 具有较好的循环性能[14, 15], 但仍然存在负极连续析氢和严重自放电[16]等问题. 目前已经研究了电解液中锌浓度[17]、 锌形态[18, 19]、 流量[20]、 温度[21]和电流密度[22]等对锌镍单液流电池负极性能的影响. 在负极集流体的选择方面, Zhang等[15]研究了Cu上镀Cd或Pb的基体, 表明锌在镉基体上沉积的电化学行为简单, 具有较高的沉积效率, 但Cd和Pb镀层在锌电极多次充放电后易脱落. 目前对于电解液添加剂对锌沉积/溶解的研究比较少. Wen等[23, 24]研究了向碱性锌酸盐溶液中添加铅及钨酸盐离子对锌沉积形貌的影响, 发现铅离子和钨酸盐离子能够有效抑制海绵锌的生长, 但溶液中需要加入的钨酸盐离子的量比较大, 同时铅也容易污染环境. 袁永锋等[25]向碱性电镀液中添加四氯化锡, 发现锡离子能够将锌的沉积形态由枝晶转变更为致密的晶粒, 但并未研究锌负极的放电. 迄今, 在改善锌镍单液流电池析氢和严重自放电方面还未见文献报道.
本文研究了锡酸钾作为电解液添加剂对锌沉积/溶解的影响, 以期改善锌镍单液流电池的析氢和自放电问题.
氢氧化钾, 分析纯, 天津博迪化工股份有限公司; 氢氧化锂和氧化锌, 分析纯, 江苏强盛功能化学股份有限公司; 锡酸钾(K2SnO2), 分析纯, 上海阿拉丁生化科技股份有限公司.
CHI608E电化学站(上海辰华仪器有限公司); 2502M K23型扫描电子显微镜(SEM, 英国CamScan公司); CT2001A蓝电电池测试系统(武汉巴特锐科技有限公司).
以8 mol/L KOH+5 g/L LiOH+0.5 mol/L K2Zn(OH)4溶液作为基础电解液, 标记为B. 含不同浓度锡酸钾的电解液通过向基础电解液中添加不同质量的锡酸钾搅拌后配制而成, 标记为B+x mol/L K2SnO3, 其中x=0.03, 0.05, 0.08, 0.1. 锡酸钾在基础电解液中25 ℃下的最大溶解度为0.1 mol/L.
负极集流体为镀镍钢带, 实验前先用乙醇擦洗除油, 再放入10%稀硫酸中静置1 min以除去表面的氧化膜, 取出后用去离子水洗涤, 并迅速放入次亚磷酸钠水溶液(质量分数10%)中保存, 负极测试前用去离子水洗净. 为了确保负极双侧与电解液接触的表面积, 负极使用时用聚四氟乙烯胶带包裹极耳.
所有测试均在室温及搅拌条件下进行. 以1 cm× 1 cm的镀镍钢带工作电极(0.05 mm厚), 2 cm× 2 cm的烧结镍作为对电极且采用双侧布置, 以Hg/HgO电极作为参比电极构成三电极体系, 电解液为前述各种溶液. 循环伏安测试的扫描速率为1, 5, 10 mV/s, 扫描电压范围为-0.6~-1.6 V(vs. Hg/HgO)[26], 进行多次扫描直至曲线重合为止; SEM样品以10 mA/cm2电流密度充电500 s获得镀层, 洗涤并保存, EDS测试样品以10 mA/cm2电流密度充电20 min获得镀层, 洗涤并保存; 恒流充放电测试以10 mA/cm2电流密度恒流充电0.5 h或以5 mA/cm2电流密度充电1.0 h, 放电截止到-0.6 V(vs. Hg/HgO).
以电池静置一定时间后的容量保持率来表征锌镍单液流电池的自放电性能, 其中静置过程中保持溶液流动. 方法为: 以2 cm× 2 cm的镀镍钢带作为负极, 2 cm× 2 cm的烧结镍作为正极且采用双侧布置构成两电极体系, 在CT2001A电池测试系统上进行测试, 测试前烧结镍电极需要预先活化[14, 15, 16], 以10 mA/cm2电流密度恒流充电到150 mA· h停止, 然后分别静置12, 24和48 h, 静置过程中溶液保持流动, 最后以10 mA/cm2电流密度恒流放电至1.2 V停止.
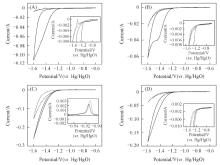
图1(A)和(B)为镀镍钢带在8 mol/L KOH+5 g/L LiOH+0.05 mol/L K2SnO3溶液中在1和5 mV/s扫描速率下的循环伏安曲线. 图1(C)和(D)为镀镍钢带在8 mol/L KOH+5 g/L LiOH 溶液中在1和5 mV/s扫描速率下的循环伏安曲线. 由图1(A)可以看出, 在1 mV/s扫描速率下首次的阴极电流比较大, 稳定后(第5周)阴极电流较首次降低较多; 因碱性锡酸盐电镀锡时沉积效率随温度降低和锡酸盐浓度减小而下降[27], 因此实验中阴极电流有较大成分的析氢电流. 如图1(A)所示, 首次扫描中阳极化分支没有出现明显的氧化峰, 而稳定后[第5周, 如图1(A)中的局部放大图]在约-1.4 V(vs. Hg/HgO)处出现1个小的氧化峰(溶解峰), 在约-0.9 V(vs. Hg/HgO)处出现很低的氧化峰(溶解峰), 且该溶解峰的大部分区域在0线以下, 说明在溶解过程中仍然伴随着较强的析氢; 但随着锡的沉积, 析氢明显减弱. 5 mV/s扫描速率下的循环伏安曲线[图1(B)]有类似的强析氢电流, 但没有出现明显的锡溶解峰[第5周, 如图1(B)中的局部放大图], 可能是沉积锡量少, 在阳极化过程中很快自溶解了. 为了研究锡的氧化还原性能, 测试了镀镍钢带在8 mol/L KOH+5 g/L LiOH溶液中1和5 mV/s扫描速率下的循环伏安曲线, 通过对比图1(A)和(C)以及图1(B)和(D)的析氢电流可以发现, 碱性电解液加入锡酸钾后析氢副反应影响减弱.
图2为镀镍钢带在8 mol/L KOH+5 g/L LiOH+0.05 mol/L K2SnO3溶液中的恒流充放电曲线, 电流密度为5 mA/cm2, 充电截止时间为充电1 h或充电截止电压为-1.6 V(vs. Hg/HgO), 放电截止电压为-0.6 V(vs. Hg/HgO). 可见, 充电电压在初期急速下降后稳定在-1.55 V(vs. Hg/HgO)左右, 放电时间很短.
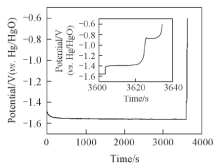 | Fig.2 Constant-current charge-discharge curves of nickel-plated steel strip in 8 mol/L KOH+5 g/L LiOH+0.05 mol/L K2SnO3 aqueous solution at a current density of 5 mA/cm2 |
从图2局部放大图可以看出, 在-1.4 V(vs. Hg/HgO)处出现了1个持续时间约20 s的放电台阶, 在-0.95 V(vs. Hg/HgO)处出现了1个持续时间约10 s的放电台阶, 与图1(A)循环伏安曲线出现锡溶解峰的位置吻合. 图2的库仑效率非常低, 也证实图1循环伏安曲线的阴极电流有较大成分的析氢电流.
图3为镀镍钢带在不同含量锡酸钾的基础电解液中不同扫描速率下的首周循环伏安曲线. 当扫描速率为1 mV/s时[见图3(A)], 随着添加锡酸钾浓度增加到0.05 mol/L及以上时, 阴极分支逐渐偏离零线, 即曲线在约-1.15 V(vs. Hg/HgO)处偏离零线[见图3(A)右上放大图]; 根据文献[27], 这是锡和锌发生了共沉积所致. 随着锡酸钾浓度增加, 循环伏安曲线的阳极峰值逐渐减小, 相应的阳极峰值出现在-1.14 V(vs. Hg/HgO)左右. 此外, 在-0.87 V(vs. Hg/HgO)左右有1个很低的阳极峰[见图3(A)右下图], 可能是锌镍合金氧化所致[26], 而且这个阳极峰只存在于基础电解液中, 可能是加入锡后形成了更稳定的合金组分. 与图3(A)不同, 当扫描速率为5 mV/s时[见图3(B)], 基础电解液中在较高的电位即开始发生电沉积, 随着锡酸钾加入及浓度增加, 开始发生电沉积的电位不断降低[见图3(B)右上图].
随着扫描速率增加, 不同电解液中循环伏安曲线的差异变得越来越不明显[对比图3(A), (B)和(C)], 当扫描速率增加到10 mV/s时, 不同电解液中的曲线趋于重合. 表明在较低的扫描速率下锡酸钾对锌沉积的影响更显著.
采用三电极体系, 以镀镍钢带为负极, 在不同锡酸钾含量的电解液中以10 mA/cm2充电20 min获得镀层, 用能谱仪(EDS)分析了镀层的元素组成. 图4为镀镍钢带在基础电解液(B)、 B+0.05 mol/L K2SnO3溶液和B+0.1 mol/L K2SnO3溶液中电沉积后EDS测试结果. 可以看出, 基础电解液中电沉积的样品中只检测到锌元素, 在B+0.05 mol/L K2SnO3溶液中电沉积的样品中检测到锌和锡, 且Zn/Sn原子比为98.86∶ 1.14, 在B+0.1 mol/L K2SnO3溶液中电沉积的样品中检测到锌和锡, 且Zn/Sn的原子比为97.35∶ 2.65, 这表明锌和锡发生了共沉积.
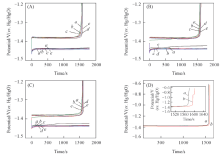
图5是镀镍钢带负极在5种不同电解液中以5 mA/cm2电流密度充电1 h及以10 mA/cm2电流密度充电0.5 h的首次充电曲线. 从图5可以看出, 在充电的初始阶段出现了电压快速下降的趋势, 并在达到最低值后升高至稳定; 随着基础电解液中锡酸钾浓度的增加, 达到最低电压的时间变短, 说明加入锡酸钾更有利于集流体表面晶核的生成. 在相同电流密度的情况下, 随着锡酸钾浓度的增加, 生成晶核的速度越快, 晶粒可能变得更细小[25]. 结合图3结果, 锡可能优先沉积在镀镍钢带表面成为晶核中心和锌沉积的基体[24], 不仅抑制了氢析出而且促进了锌的均匀沉积.
图6是镀镍钢带在不同电解液中于10 mA/cm2电流密度下的恒流充放电曲线, 其中充电时间为0.5 h. 从图6(A)可以看出, 基础电解液中加入锡酸钾后, 充放电电压平台均负向移动, 且库仑效率比基础电解液中略高; 由图6(B)和(C)可以发现, 随着循环次数的增加, 加入锡酸钾的溶液中充放电电压平台比基础电解液负移的现象总是稳定存在, 说明锡的作用是持续的. 从图6还可以看出, 在充电初期, 加入锡酸钾的溶液中形核过电位比基础电解液中的大, 且随锡酸钾浓度的增加而变大, 与图5结果基本一致; 但是图6中形核过电位的持续时间比图5小很多, 应该是前期的溶解过程不完全[14, 15, 26], 并没有完全形成镀镍钢带原始表面所致. 从第6次循环开始[见图6(B)], 基础电解液中的沉积电位经过初期稳定段后有逐渐正移的趋势, 说明基础电解液中沉积层表面积有逐渐增大的趋势, 易于形成枝晶生长; 而加入锡酸钾的溶液中沉积电位没有出现此趋势, 说明锡的存在可以持续抑制枝晶的生成. 从图6(D)可以看出, 基础电解液中加入锡酸钾后的溶解过程总出现锡的溶解平台, 说明在此电位范围内锡也可以完成沉积-溶解循环, 从而利于负极的沉积过程中形成稳定的锌锡共沉积及持续抑制枝晶的生成.
为了更直观地了解锡酸钾的作用, 采用三电极系统对镀镍钢带负极以10 mA/cm2的电流密度充电500 s, 所得表面镀层的SEM照片见图7. 从图7可以看出, 基础电解液中的锌沉积颗粒[图7(A)]相对较大, 颗粒尺寸大小差距也大; 随着锡酸钾浓度的增加[图7(B)~(E)], 镀层颗粒不断细化且更加均匀平整. 结合上文的循环伏安及恒流充电的测试结果可以看出, 锡加入引发了基底效应[14, 15, 24~26], 发生了锌、 锡共同沉积, 晶粒尺寸变得细小, 粒度分布也随锡酸钾浓度的增加变得更均匀. 这表明锡酸钾的加入明显改善了电沉积过程中晶粒的生长, 随着锡酸钾浓度的增加, 可获得更快的形核率, 产生较小尺寸的晶粒[28], 使晶体生长密度增加[29].
图8是镀镍钢带在不同电解液中充电并静置不同时间后的放电曲线. 可以看出, 充满电静置12, 24或48 h后, 基础电解液下的库仑效率分别为60.0%, 47.2%, 21.8%; 加入0.03 mol/L锡酸钾后, 库仑效率分别为74.9%, 48.6%和23.2%; 加入0.05 mol/L锡酸钾后, 库仑效率分别为77.6%, 53.4%和27.2%; 加入0.08 mol/L锡酸钾后, 库仑效率分别为80.5%, 54.5%和32.4%; 加入0.1 mol/L锡酸钾后, 库仑效率分别为81.1%, 61.1%和44.0%. 对比后可以发现, 向基础溶液中加入锡酸钾后自放电现象得到了明显的改善, 添加0.1 mol/L锡酸钾抑制自放电效果最佳. 此外, 基础电解液加入锡酸钾后的放电曲线在约1.3 V出现1个很短的平台, 应对应锡的溶解, 与图6(D)结果一致.
通过以上研究结果推测锡的作用机理如下: 因锡的沉积电位远高于锌, 部分锡在电沉积(充电)时优先沉积在镀镍钢带的活性位上, 锡沉积物成为锌的成核晶粒; 当电位达到锌沉积电位时, 发生锌锡共沉积, 锡继续还原并影响锌的晶体优先生长方向, 从而改变沉积物形态[25, 30]. 向基础溶液中添加锡酸钾后, 镀层更加平整致密, 在一定程度上减缓了锌的自溶解. 形成锌锡合金后, 锌的活性相对减弱, 且锡覆盖了镀镍钢带的活性位将阻止活性位与溶液的接触, 从而降低原电池型析氢自溶解; 另一方面, 锡是析氢过电位很强的金属, 具有一定抑制析氢的作用, 且直到电位高至-0.95 V(vs. Hg/HgO)时锡仍存在(见图2), 可使锌在整个放电电位区间保持相对较低的自溶解活性. 因此, 加入锡酸钾在一定程度上改善了锌负极的自放电现象.
研究了锡酸钾作为电解液添加剂在流动的高浓度锌酸钾溶液中对锌负极沉积/溶解行为的影响. 研究结果表明, 充电过程发生了锌和锡共沉积; 向基础溶液中添加锡酸钾, 有利于晶种的产生和晶粒的生长; 加入锡酸钾一定程度上改善了锌负极的自放电现象, 相比于基础电解液, 电解液中加入0.1 mol/L锡酸钾后自放电现象得到明显抑制.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|