联系人简介: 唐春梅, 女, 博士, 教授, 主要从事纳米材料的物理化学特性研究. E-mail: tcmnj@163.com
对外掺杂碱土金属Mg的B40硼笼的储氢性能进行了密度泛函理论研究. 结果表明, B40笼含有2个六元环与4个七元环. 多个Mg原子对B40笼进行外掺杂时不会发生成簇现象, 有利于进一步储氢. Mg原子外掺杂的B40笼对H2分子的平均吸附能介于物理吸附与化学吸附之间(0.1~0.8 eV). 体系的储氢密度达到7.60%(质量分数). 储氢结构能在常温常压下释放H2分子, 因此, Mg原子外掺杂的B40笼比Mg合金具有更好的储氢性能.
The density functional theory(DFT) was used to study the hydrogen storage capacity of alkaline earth metal Mg exohedral doped B40 cage structure. There are two B6 hexagon rings and four B7 heptagon rings in the B40 cage. The clustering of the Mg atoms on the surface of the B40 cage can be effectively avoided, which should be benefit for the further hydrogen storage. The average adsorption energy of H2 molecules is intermediate between physical adsorption and chemisorption. The hydrogen gravimetric density of B40Mg6 is 7.60%(mass fraction), which far exceed the target of 5.5%(mass fraction) by the year 2017 specified by the US Department of Energy. The hydrogen adsorbed structure tends to desorb hydrogen under the near-ambient conditions. Therefore, the Mg atom exohedral doped B40 cage has better hydrogen storage capacity than Mg alloy. This research can provide a very important theoretical basis for the development of hydrogen storage materials.
氢气作为一种高效清洁能源, 存储是关键, 发展高性能储氢材料是解决氢存储的主要途径. 然而, 寻找常温常压下稳定的高容量储氢材料是一个巨大挑战[1, 2]. 美国能源部对储氢材料设定了在2017年达到质量分数5.5%的储氢密度目标[3]. 储氢材料如果能实现在常温常压下储氢, 那么对每个H2分子的平均吸附能(Ead)应介于物理吸附与化学吸附之间(0.1~0.8 eV)[4, 5, 6].
自从实验制备得到
硼原子的质量比碳原子的小, 因此, 使用硼材料储氢能有效提高体系的储氢密度. 2007年, Szwacki等[17]提出由80个硼原子构成的二十面体B80与C60等电子, 因此被称为“ 硼富勒烯” . 2014年, 研究发现了类似石墨烯的二维硼平面, 称之为“ 硼石墨烯” [18]. 但是, 原子数大于28的硼团簇更倾向于形成稳定的笼状结构[19]. 研究发现, 大多数硼笼与H2分子结合太弱, 如B80对H2分子的吸附能仅为0.07 eV[19]. 而经金属原子掺杂的硼笼的储氢性能明显提高, 但是, 掺杂金属必然会降低体系的储氢密度, 因此, 采用轻质量的碱金属或碱土金属掺杂的纳米材料具有较理想的储氢密度. 如碱金属Na原子掺杂的B80Na12笼的储氢密度高达11.2%[19]. 目前, 对经碱(碱土)金属掺杂的硼笼的储氢性能已开展了广泛研究, 如Ca原子掺杂的B38笼[20]、 碱金属掺杂的B80笼[21]、 Na原子掺杂的B6笼[22]等均具有良好的储氢性能.
2014年, 实验测定了笼状结构B40的光电子能谱[19], 分析得知, B40笼表面的B原子通过离域的σ 键和π 键结合, 笼结构中含有2个六元环与4个七元环[23, 24]. Dong等[25]报道了Ti原子掺杂的B40笼具有良好的储氢性能. Fa 等[26]对Li, Na, K, Ba, Ti 等金属在B40笼中的最稳定位置进行了研究, 得知Na原子和Ba原子最稳定的位置在笼中心. Jin等[27]发现, 经过Sc(Y, La)原子外掺杂的B40笼的储氢密度高达8.2%. Zhang等[28]发现, 经过6个Ca原子外掺杂的B40笼的储氢密度高达8.11%. 碱土金属Mg与Ca均位于元素周期表Ⅱ A主族, 但Mg原子的质量比Ca原子的小, 而且在自然界中储量丰富, 采用碱土金属Mg原子对 B40笼进行掺杂会更有优势, 也会具有更高的储氢价值. 另外, 研究发现Mg合金用于储氢时, Mg合金对氢的结合力较强, 不容易释放氢[29]. Santanu等[30]已经对9种不同的金属原子(Na, K, Ru, Be, Mg, Ca, Sr, Sc, Ti)在B40笼内外的最稳定位置进行了计算研究, 确定B40笼的孔洞外部位置是Mg原子的最稳定位置. 实验上已对Li12@C60的储氢性能进行了测试, 证明其具有良好的储氢性能[31], 但到目前为止, 还没有对Mg原子掺杂的B40笼的储氢性能的研究报道. 本文选用碱土金属Mg原子对B40笼状结构进行掺杂, 并研究其储氢性能. 该研究可以为开发储氢材料提供非常重要的理论依据.
采用Material Studio软件的Dmol3模块[32]进行几何结构优化和电子性质计算. 主要采用密度泛函理论(DFT)[33]中的广义梯度近似(GGA)[34]方法完成. 计算选取Perdew-Burke-Ernzerhof(PBE)[35]交换关联势和包含极化函数扩展的双数值原子轨道的DNP基组. 对H, B和Mg采用全电子计算. 因为GGA会低估体系的结合能, 所以本文采用近似半经验的DFT-D修正方案, 主要为交换关联势中的PBE-Grimme[36]色散修正方法. PBE-Grimme的准确性已经通过对储氢体系的计算得到充分论证[37, 38, 39]. 几何结构优化以能量、 梯度和位移是否收敛为依据, 能量、 力(梯度)、 位移的收敛标准分别为2.722× 10-4 eV, 0.0054 eV/nm和0.0005 nm. 自洽场过程以体系的能量是否收敛为依据, 自洽场能量收敛标准为2.722× 10-5 eV. 计算了体系的自然键轨道(NBO)电荷, NBO电荷分析使用广泛, 对于多数体系给出的NBO电荷值比较合理[40, 41, 42].
为了检验所用计算方法的准确性, 首先使用上述计算方法对B6和B36团簇进行结构优化. B6优化结构中B1-B3和B1-B4键长分别为0.153和0.161 nm, 与Alexandrova等[43]使用PBE0泛函和 6-311G* 基组计算得到的相应键长(0.152和0. 158 nm)之间的误差只有1.2%和1.7%. 优化结构B36中外沿的B-B键长最短为0.160 nm, 最长为0.167 nm, 与Piazza等[44]使用BLYP泛函和6-311G* 基组计算得到的结果(0.158和0.167 nm)之间的误差只有1%和0.002%. 因此, 以上结果表明所采用的计算方法可靠.
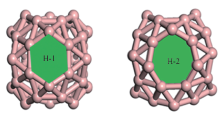
图1给出了B40笼状结构图. 由图1可知, B40笼由8根水平方向的B9带和4根垂直方向的B10带相互交织而成, 笼子顶部与底部分别有1个六元环(H-1), 同时腰部有4个七元环(H-2)[23, 24]. 研究结果表明, Mg原子在B40笼子中的最稳定位置是位于笼子的孔洞外部, 有利于进一步储氢[22]. 为了确认孔洞外部是否为Mg原子最稳定的位置, 对Mg原子可能稳定的位置进行全面计算研究. 由几何结构可知, B40笼子内部和外部共有5个不等价位置, 分别是笼内靠近六元环处(H-1 inside), 笼内靠近七元环处(H-2 inside), 笼子中心(center), 笼外靠近六元环处(H-1 outside)及笼外靠近七元环处(H-2 outside). 为了进一步找出Mg原子的最稳定掺杂位置, 分别在这5个不同位置放置1个Mg原子, 如图2所示.
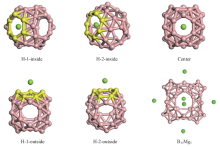 | Fig.2 Mg atom located at H-1-inside, H-2-inside, the cage center, H-1-outside, H-2-outside and the structure of B40Mg6 |
计算了Mg原子在各位置的结合能(Eb)[19]:
式中:
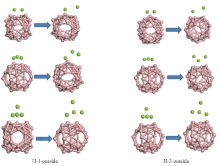 | Fig.3 Initial and optimized structures of the B40 cage adsorbed by 2— 4 Mg atoms outside of the hexagonal ring and heptagonal ring |
式中: n为Mg原子的个数.
表1列出了Mg原子在B40笼外靠近六元环和七元环的平均结合能. 由表1可知, 2~4个Mg原子在六元环和七元环外部的平均结合能均大于固体Mg的实验内聚能(1.51 eV[45]), 而且初始距离都很近的相邻2个Mg原子之间的距离优化之后都增大到0.30 nm以上, 如图3所示, 因此, Mg原子与B40笼之间的结合强度要强于与相邻Mg原子之间的结合强度, 可以证明多个Mg原子掺杂在B40表面不会成簇. 在B40笼的每个孔洞外部各放置一个Mg原子(如图2所示). 计算得知, 6个Mg原子的平均结合能(B40的总能量与6个Mg原子总能量之和减去B40Mg6的总能量再除以6)为2.58 eV, 虽然小于一个Mg原子在B40表面的结合能, 但是仍远大于固体Mg的实验内聚能(1.51 eV[45]), 进一步证明多个Mg原子掺杂在B40表面时可以避免成簇而有效储氢.
| Table 1 Eab of the Mg atom outside of the hexagonal ring(H-1-outside) and the heptagonal ring(H-2-outside) of the B40 cage |
由表1还可知, Mg原子在七元环外部的结合能大于在六元环外部的结合能, 说明位于较大孔洞外部的金属原子会体现更大的结合强度. 具体分析可知, 位于六元环外部的Mg原子所带电荷为1.08 e, 与孔洞之间的距离为0.259 nm; 位于七元环外部的Mg原子所带电荷为1.15 e, 与孔洞之间的距离为0.255 nm. 因此, Mg原子离得越远, 与笼之间的结合越弱, 失去的电荷越少. 另外, Mg与Ca同属Ⅱ A族碱土金属, Mg和Ca在B40的六元环外和七元环外时的结合情况相近[25].
在Mg原子周围分别放置1~5个H2分子, 注意将H2分子放置在Mg周围一个适合的距离之内. 优化结构如图4所示, 优化结构中的H— H键长(0.075 nm)与孤立的H2分子键长(0.074 nm)几乎相等, 因此, 自由的H2分子被Mg原子吸附时仍保持分子形态, 并未分裂为2个H原子. 当每个Mg原子吸附5个H2分子时, 第5个H2分子会跑到比较远的位置, 因此, 每个Mg原子最多能吸附4个H2分子.
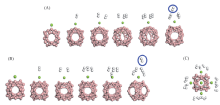 | Fig.4 Structures of B40Mg and B40Mg-nH2(n=1— 5) with the Mg atom outside of the hexagonal ring(A) and heptagonal ring(B) and B40(Mg-4H2)6 structure with each Mg atom adsorbing four H2 molecules(C) |
计算了B40Mg对H2分子的平均吸附能(Ead)和连续吸附能(Er)(列于表2), 计算公式如下[46]:
式中:
| Table 2 Eb of the Mg atom to the hexagonal ring(H-1-outside) and the heptagonal ring(H-2-outside) of the B40 cage and the Ead of B40Mg-nH2(n=1— 5) |
为了验证上述结论, 使用18电子规则[47]从理论上对位于B40笼六元环、 七元环外部的Mg原子吸附的H2最大数目进行计算, 公式如下:
式中: nH为被吸附的H2分子中总的H原子数;
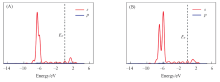
图5给出了 B40Mg-H2和B40Mg-2H2(H-1-outside)中H2的部分态密度(PDOS). 态密度图是通过对体系的离散能级进行洛伦兹展开, 由水平轨道给出的权重求和而得到, 费米能级(EF)位于0处, 在图中用黑色虚线表示. 由图5(A)可知在-2 eV附近, H2的PDOS有几个低峰, 这对应于H2的σ * 轨道, 结合NBO电荷可知, Mg原子在吸附第1个H2分子时存在Dewar-Kubas作用, 即H2的σ 轨道上的电子转移到Mg原子的空p轨道上(Dewar作用[48]), 另外, Mg原子被填充满的p轨道又反过来将电子转移到H2的σ * 轨道上(Kubas作用[49, 50, 51]), H2分子的H— H键长变长. 此时Mg原子带有1.08 e的电荷, Mg原子产生的极化电场使更多的H2分子被吸附. 因此在吸附第2个H2时, H2的PDOS由1个峰分裂为2个峰, 如图5(B)所示, 证明Mg原子和H2分子的轨道之间发生了相互作用. 当每个Mg原子吸附4个H2分子时, 其中3个H2只含有0.002 e的电荷, 因此B40Mg主要依靠极化作用吸附第2~4个H2分子. 综上所述, Mg原子掺杂的B40笼对H2分子的作用既包含Dewar-Kubas作用[51]又包含极化作用, 当体系吸附多个H2时, 极化作用占主导地位.
为了研究储氢体系的氢释放性能, 使用Nose-Hoover Chain thermostats动力学方法对储氢体系进行有限的温度调节动力学计算. 图6给出了位于B40六元环和七元环外部时Mg原子吸附4个H2分子的结构分别在77和300 K温度下模拟5 ps后的动力学结构图. 计算发现, 在温度为77 K、 步长为1 fs时, 储氢结构在5 ps后保持完整, 位于六元环和七元环外部的Mg原子均释放1个H2分子. 而在温度为300 K、 步长为1 fs时, 储氢结构在5 ps后保持完整, 位于六元环、 七元环外部的Mg原子在5 ps后分别释放2个和3个H2分子, 因此, 可预测在较高的温度下, 更多的H2分子将会被释放出来. 上述结果表明Mg原子掺杂的B40笼对H2具有良好的可逆吸附性能.
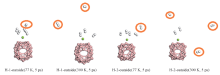 | Fig.6 Dynamic structure B40Mg-4H2 with the Mg atom located outside of the hexagonal ring and heptagonal ring of B40 after 5 ps at 77 and 300 K |
进一步根据巨配分函数[52]求得在一定温度下体系能够吸附的平均H2分子数, B40Mg在温度T时能够吸附的平均H2分子数为
式中: k为玻尔兹曼常数; T为开尔文温度; EaN(eV)为体系吸附N个H2分子时的平均吸附能; μ 为一定压强和温度下H2的化学势. 为了得到接近或者常温常压的条件下释放的H2分子数目, 设置压强为1× 105 Pa, 温度为400 K进行计算. 由式(6)计算可知, 在1× 105 Pa, 400 K的条件下, Mg原子在六元环和七元环外能够吸附的平均H2分子数
笼状结构 B40笼子的六元环和七元环外部位置是Mg原子的最稳定位置, Mg原子在六元环和七元环外部的结合能分别为4.96和4.00 eV, 均大于Mg的实验内聚能(1.51 eV), 证明多个Mg 原子在B40表面进行外掺杂时可以避免成簇. B40Mg6中的每个Mg原子可以吸附4个H2分子, 对H2分子的平均吸附能介于物理吸附与化学吸附之间. B40Mg6主要通过Dewar-Kubas作用吸附第1个H2分子, 通过电场极化作用吸附第2~4个H2分子. 动力学模拟结果和巨配分函数计算结果表明, 该储氢结构能在常温常压下释放H2; 与镁合金相比, Mg原子掺杂的B40相可以成为良好的储氢材料, 实现常温常压下的可逆储氢.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|