联系人简介: 吴爱国, 男, 博士, 研究员, 博士生导师, 主要从事纳米材料的制备与应用研究. E-mail: aiguo@nimte.ac.cn; 李 娟, 女, 博士, 副研究员, 主要从事抗肿瘤纳米药物研究. E-mail: lij@nimte.ac.cn
采用溶剂提取和萃取方法得到白山毛桃根乙酸乙酯、 正丁醇和水层萃取物. 通过噻唑蓝(MTT)比色法考察了各萃取物对脑胶质瘤细胞U87MG活性的抑制作用. 采用高效液相色谱(HPLC)指纹图谱法比对确认活性部位的主要化学成分为2 α,3 α,24-三羟基-12-烯-28-乌苏酸. 采用溶剂挥发法制备了2 α,3 α,24-三羟基-12-烯-28-乌苏酸纳米胶束, 对其包封率、 粒径及 ζ电位等进行了表征, 并考察了其抗肿瘤活性. 体外细胞实验结果表明, 白山毛桃根乙酸乙酯萃取物对脑胶质瘤细胞U87MG具有抑制作用, 通过与标准品比对确认2 α,3 α,24-三羟基-12-烯-28-乌苏酸为乙酸乙酯部位的主要成分, 且该成分对脑胶质瘤细胞活性具有较强抑制作用. 通过溶剂挥发法制备的2 α,3 α,4-三羟基-12-烯-28-乌苏酸纳米胶束包封率为64.7%, 粒径为20 nm, 粒径分布宽度(PDI)为0.246, ζ电位为-5.7 mV. 细胞实验结果进一步证明, 与单体化合物相比, 2 α,3 α,24-三羟基-12-烯-28-乌苏酸纳米胶束对脑胶质瘤细胞活性具有更强的抑制作用, 为白山毛桃根在脑胶质瘤治疗中的应用提供了实验依据.
Actinidiaeriantha Benth was extracted by ethyl acetate, n-butyl alcohol and water, and three fractions were obtained. The in vitro cell experiments showed that ethyl acetate was the anti-glioma active fraction of the root of Actinidiaeriantha Benth. The high performance liquid chromatographic fingerprint confirmed that main compound of ethyl acetate fraction was 2 α,3 α,24-trihydroxyurs-12-en-28-oic acid, and it could significantly inhibit the glioma cell activity. The prepared 2 α,3 α,24-trihydroxyurs-12-en-28-oic acid loaded nanomicelles was with high loading efficiency of 64.7%, average diameter of 20 nm with polydispersity index(PDI) of 0.246 and ζ potential of -5.7 mV. Further cell experiment demonstrated the 2 α,3 α,24-trihydroxyurs-12-en-28-oic acid loaded nanomicelles through solvent evaporation with better inhibitory effects on the glioma cells than free one. Taken together, the ethyl acetate fractions from the root of Actinidiaeriantha Benth were confirmed with the anti-glioma activity, and 2 α,3 α,24-trihydroxyurs-12-en-28-oic acid was the main active compound. The prepared 2 α,3 α,24-trihydroxyurs-12-en-28-oic acid loaded nanomicelles was with good water dispersity and anti-glioma activity, providing solid experimental base for the application of the root of Actinidiaeriantha Benth in glioma therapy.
白山毛桃根为猕猴桃科植物毛花猕猴桃Actinidiaeriantha Benth的干燥根, 具有解毒消肿及清热利湿的功效, 为畲族习用药材[1, 2]. 研究发现, 白山毛桃根具有显著的抗肿瘤作用, 对肝癌细胞[3, 4]、 胃癌细胞[5]、 鼻咽癌细胞[5]和黑色素瘤[6]等均具有较好的抑制作用. 卢泳庄[7]从白山毛桃根中分离得到单体化合物2α , 3α , 24-三羟基-12-烯-28-乌苏酸, 并发现该化合物对人肝癌细胞株HepG-2、 人前列腺癌细胞株pc3、 人胃癌细胞株BGC-823和人结直肠腺癌SW620的增殖均有显著的抑制作用. 进一步的研究表明, 2α , 3α , 24-三羟基-12-烯-28-乌苏酸的抗癌作用与其促进细胞凋亡有关. 白山毛桃根提取物可通过下调蛋白Bcl-2, Caspase-9和Caspase-3的表达而诱导ECA-109细胞的凋亡[8]. 但是, 迄今白山毛桃根对脑胶质瘤细胞的抑制作用鲜见报道. 在颅内肿瘤中, 脑胶质瘤约占50%~60%, 是最常见的中枢神经系统原发性恶性肿瘤, 具有发病率高、 存活率低且易复发等特点[9, 10]. 因此, 迫切需要研发新型的抗脑胶质瘤药物. 随着纳米技术的不断发展, 其在抗肿瘤中药药物递送领域得到了广泛应用. 纳米技术的应用不仅能够改善中药有效成分的水溶性和生物利用度, 还可以避免光、 pH值和酶等对中药有效成分的破坏, 保持稳定性. 此外, 通过纳米载体的尺寸调控和表面功能基团修饰还可以提高中药有效成分对肿瘤部位的靶向性, 降低其对正常组织器官的毒副作用[11, 12, 13]. 因此, 将纳米技术应用于中药制剂可以显著提高中药的临床应用价值和实用意义[14, 15, 16].
本文研究了白山毛桃根的不同萃取部位对脑胶质瘤的抑制作用, 并通过指纹图谱比较的方法确定了2α , 3α , 24-三羟基-12-烯-28-乌苏酸为有效活性成分. 由于2α , 3α , 24-三羟基-12-烯-28-乌苏酸具有较强的疏水性, 进一步对其进行纳米胶束改性, 在增加其水溶性的同时, 增强了其对脑胶质瘤细胞的活性抑制作用, 为白山毛桃根在脑胶质瘤治疗中的应用提供了实验依据.
白山毛桃根, 2017年6月30日采集于浙江丽水市, 经浙江医药高等专科学校龙正海教授鉴定为白山毛桃根Actinidiaeriantha Benth, 标本(YP-2017063011)收藏于天然产物研究室; 二硬脂酰磷脂酰乙醇胺-聚乙二醇2000(DSPE-PEG2000, 上海亚亦生物有限公司); 3-(4, 5-二甲基噻唑-2)-2, 5-二苯基四氮唑溴盐、 二甲基亚砜、 色谱级乙腈及色谱级磷酸(上海阿拉丁生化科技股份有限公司); Minimum Eagle’ s medium培养基(MEM)和南美胎牛血清(美国海克隆生物化学制品有限公司); U87-MG人脑胶质瘤细胞(中国科学院细胞库); 2α , 3α , 24-三羟基-12-烯-28-乌苏酸(中国药品生物制品检定所); 丙酮及其它有机溶剂(国药集团化学试剂有限公司).
X-1300型旋转蒸发仪(上海爱朗仪器有限公司); 96孔板读数仪(美国Biorad公司); 1600型高效液相色谱(HPLC, 美国安捷伦公司); Nano ZS粒径分布及Zeta-电位仪(英国马尔文公司).
将1 kg干燥的白山毛桃根粉碎, 用体积分数为70%的乙醇加热回流提取2次, 每次加入10 L乙醇回流2 h, 减压回收乙醇至无醇味, 得到乙醇浸膏56.9 g. 将乙醇浸膏用水分散成悬浊液, 依次用乙酸乙酯和正丁醇各萃取3次, 合并相同溶剂萃取液浓缩至恒定质量, 采用相同方法浓缩母液层至恒量, 分别得到乙酸乙酯、 正丁醇和母液的干燥萃取物[17, 18].
1.3.1 样品溶液的制备 将适量乙酸乙酯干燥萃取物置于10 mL烧杯中, 加入适量乙酸乙酯至分散完全后, 转移至25 mL容量瓶中, 于25 ℃超声处理(500 W, 频率40 kHz)30 min, 冷却、 定容、 摇匀、 过滤, 即得萃取物溶液, 用于细胞实验. 其余萃取物的操作与此相同.
1.3.2 脑胶质瘤细胞抑制活性测试 用含有体积分数为10%胎牛血清的MEM完全培养液, 在含有体积分数为5% CO2的37 ℃培养箱中培养U87-MG细胞; 每次传代按照4∶ 1比例传代, 选择第3~7代细胞进行实验. 在进行毒性实验前, 将细胞用体积分数为0.25%的胰酶溶液解离, 再按照104 Cell/孔的细胞密度种植, 贴壁24 h后, 用含有不同样品的MEM培养液进行替换后共孵育; 共孵育24 h后, 每孔加入10 μ L 3-(4, 5-二甲基噻唑-2)-2, 5-二苯基四氮唑溴盐溶液(5 mg/mL); 在培养箱中继续培养4 h后吸出原溶液, 加入200 μ L二甲基亚砜后, 置于96孔读数仪中, 读取每孔在550 nm处的吸光值; 以空白组的吸光值为100%, 计算不同浓度样品的细胞存活率.
1.3.3 数据处理 细胞抑制活性测试每组重复3次, 取平均值并计算误差数.
1.4.1 干燥萃取物溶液的制备 将适量干燥萃取物溶解于丙酮中, 配制成浓度为1 mg/mL的溶液, 过滤后置于4 ℃冰箱中备用.
1.4.2 标准品溶液的制备 将2α , 3α , 24-三羟基-12-烯-28-乌苏酸标准品粉末溶解于丙酮中, 配制成1 mg/mL的溶液, 置于4 ℃冰箱中备用.
1.4.3 色谱条件 选用Agilent TC-C18(4.6 mm× 250 mm, 5 μ m)色谱柱, 色谱条件参照文献[7].
1.5 2α , 3α , 24-三羟基-12-烯-28-乌苏酸的脑胶质瘤细胞抑制活性测试
1.5.1 定量分析 将配制好的2α , 3α , 24-三羟基-12-烯-28-乌苏酸丙酮溶液稀释成0.01, 0.02, 0.04, 0.08, 0.1及0.15 mg/mL的标准溶液, 用高效液相色谱分析. 根据所配制溶液相应的信号强度, 以峰面积为纵坐标, 浓度为横坐标进行线性回归, 得到浓度回归方程.
1.5.2 纳米胶束的制备 将25 mg DSPE-PEG2000溶解于1 mL丙酮中, 并加入1 mL 2α , 3α , 24-三羟基-12-烯-28-乌苏酸的丙酮溶液(1 mg/mL), 充分混合后逐滴加至2 mL去离子水中, 搅拌5 min后, 于37 ℃旋转蒸发除去丙酮; 将所得溶液用0.22 μ m无菌滤膜过滤, 得到均匀胶体溶液, 置于4 ℃冰箱中保存, 备用. 胶束中2α , 3α , 24-三羟基-12-烯-28-乌苏酸的浓度由高效液相色谱测定.
1.5.3 U87MG脑胶质瘤细胞抑制活性检测 将U87-MG细胞按照104 Cell/孔的密度种植, 在贴壁24 h后, 用含有不同浓度样品的MEM完全培养液替换; 共孵育24 h, 采用噻唑蓝比色法计算不同浓度样品的细胞存活率.
将3种萃取物干燥粉末溶解并与U87MG脑胶质瘤细胞共孵育24 h后发现, 除乙酸乙酯萃取物外, 与对照组相比, 其余萃取物对U87MG细胞均无明显的杀伤作用. 由图1可见, 当乙酸乙酯萃取物浓度为2.5 mg/mL时, 其对细胞具有较好的抑制作用, 细胞存活率为21.6%; 浓度为5 mg/mL时, 细胞存活率为7.9%; 而浓度为1 mg/mL时未表现出明显的细胞抑制作用, 说明其对脑胶质瘤细胞的抑制活性作用存在浓度依赖性, 与文献[19, 20, 21]报道的在其它肿瘤细胞中的作用结果类似.
图2谱线a为2α , 3α , 24-三羟基-12-烯-28-乌苏酸标准品HPLC谱线, 其在保留时间为32.9 min处出现1个较强的吸收峰, 结合紫外吸收谱图分析, 可确定为2α , 3α , 24-三羟基-12-烯-28-乌苏酸标准品的出峰时间. 图2谱线c为乙酸乙酯萃取物的HPLC谱线, 在32.9 min处出现1个较强吸收峰. 正丁醇萃取物(图2谱线b)和水层提取物(图2谱线d)在此处均未出现明显的吸收峰. 此外, 液相色谱-质谱联用测试结果表明, 二者32.9 min处的质谱数据显示它们的分子量也吻合, 分别为487.3425和487.3422, 这些数据可以与2α , 3α , 24-三羟基-12-烯-28-乌苏酸标准品的特征峰相应匹配. 上述结果均表明, 乙酸乙酯萃取物对脑胶质瘤的抑制作用有可能主要来源于其中的有效成分2α , 3α , 24-三羟基-12-烯-28-乌苏酸. 为进一步确定其对脑胶质瘤的抑制作用, 对其进行体外抗脑胶质瘤细胞活性测试.
将2α , 3α , 24-三羟基-12-烯-28-乌苏酸丙酮溶液稀释成0.01, 0.02, 0.04, 0.08, 0.1及0.15 mg/mL的标准溶液, 进行色谱分析, 以峰面积为纵坐标, 以浓度为横坐标进行线性回归, 发现二者有良好的线性关系, 线性方程为y=17705x+5.7837(R2=0.9999). 结果表明, 2α , 3α , 24-三羟基-12-烯-28-乌苏酸浓度与色谱出峰面积具有较好的线性关系, 因此其浓度可由高效液相色谱测定.
由于2α , 3α , 24-三羟基-12-烯-28-乌苏酸的疏水性较强, 故采用DSPE-PEG2000制备纳米胶束以增加其水溶性, 同时比较其与2α , 3α , 24-三羟基-12-烯-28-乌苏酸单体化合物在体外对脑胶质瘤细胞抑制活性的差异. 利用旋转蒸发法制备了纳米胶束. 将其破乳后, 利用高效液相色谱对其中2α , 3α , 24-三羟基-12-烯-28-乌苏酸含量进行测定, 包封率为(64.7± 2.5)%. 对其进行粒径分布测试发现, 其粒径约为20 nm, 粒径分布宽度(PDI)为0.246, ζ 电位为(-5.7± 1.7) mV, 图3给出其TEM照片, 可见该纳米胶束形貌均一且分散性较好, 粒径小于20 nm. 以上数据表明, DSPE-PEG 2000可以对2α , 3α , 24-三羟基-12-烯-28-乌苏酸进行包裹, 并形成较稳定且分散均一的纳米胶束.
2α , 3α , 24-三羟基-12-烯-28-乌苏酸及其纳米胶束在浓度为40和80 μ g/mL时细胞存活率均小于20%(见图4), 说明其对脑胶质瘤具有较好的抑制作用, 从而可以确定乙酸乙酯萃取物对脑胶质瘤细胞具有抑制作用的有效成分之一为2α , 3α , 24-三羟基-12-烯-28-乌苏酸. 当浓度为20 μ g/mL时, 载药纳米胶束相对于游离药物表现出更强的细胞抑制活性, 说明增强其水溶性可以有效提高2α , 3α , 24-三羟基-12-烯-28-乌苏酸的肿瘤细胞抑制活性, 为其后在脑胶质瘤治疗中的应用提供了依据. 当浓度小于10 μ g/mL时, 载药纳米胶束和游离药物均未表现出明显的抑瘤效果, 这与之前乙酸乙酯萃取物在低浓度时对肿瘤细胞抑制作用低的结果相似(图1), 说明2α , 3α , 24-三羟基-12-烯-28-乌苏酸对脑胶质瘤的抑制作用存在浓度依赖性, 与文献[5]报道的白山毛桃根乙酸乙酯萃取物对SGC-7901细胞的抑制作用类似. 虽然, 在体外实验中2α , 3α , 24-三羟基-12-烯-28-乌苏酸体现了良好的对脑胶质瘤的抑制效果, 但在实际体内应用过程中还需要克服如体内清除及血脑屏障等阻碍才能有效用于临床实验, 靶向纳米制剂的快速发展也为这一类疏水性药物的体内治疗提供了新的希望.
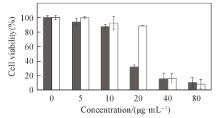 | Fig.4 Cell inhibition effect of 2α , 3α , 24-trihydroxyurs-12-ene-28-olic acid( ) and its nanomicelles( ) and its nanomicelles( ) on U87MG cell for 24 h ) on U87MG cell for 24 h |
综上所述, 对白山毛桃根的乙酸乙酯、 正丁醇和水层萃取物进行脑胶质瘤细胞抑制活性研究发现, 乙酸乙酯萃取物的抑制活性最佳. 采用高效液相色谱法对乙酸乙酯萃取物的化学成分进行分析, 发现2α , 3α , 24-三羟基-12-烯-28-乌苏酸为该部位的主要化合物. 药理实验验证该化合物具有较好的抗脑胶质瘤细胞活性. 细胞实验结果证明, 制成纳米胶束可以显著提高其对脑胶质瘤细胞的抑制作用. 本文结果为白山毛桃根及其单体化合物在脑胶质瘤治疗中的应用提供了参考.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|






 n-Butanol extraction layer;
n-Butanol extraction layer;  ethyl acetate extraction layer;
ethyl acetate extraction layer;  water extraction layer.
water extraction layer.