联系人简介: 董俊军, 男, 博士, 副教授, 主要从事多肽合成方面的研究. E-mail: dongjj536@sina.com
基于碳酸酯结构易于亲核脱除的原理, 使用氯甲酸氯甲酯改构Wang树脂, 并探究了改构树脂与首位氨基酸的缩合效率. 实验结果表明, 改构后的Wang树脂与20种Fmoc保护氨基酸均能达到70%以上的缩合效率; 且对于带有较大侧链基团的Fmoc保护氨基酸, 通过降低树脂取代度或延长反应时间可提高其连接率. 为了验证改构后的碳酸酯型树脂在裂解时侧链未受到影响, 设计合成了3种模型肽, 并用温和裂解剂3-吡啶甲醛肟铯盐进行裂解. 实验结果表明, 利用改构树脂能得到侧链全保护的肽片段, 可初步应用到长链困难肽的合成中.
Because of the carbonate structure is removed by nucleophilic agents easily, methyl chloroformate was used to modify Wang resin, and the condensation efficiency of modified Wang resin with the first amino acid was studied. The results showed the condensation efficiency of the modified resin to 20 kinds of Fmoc amino acids could run up to 70%. In order to increase the condensation efficiency of the modified resin with the Fmoc amino acids achieving larger side chain groups, the degree of resin substitution was reduced and the reaction time was prolonged. In order to prove the protected side chain group would not be damaged under cleavage conditions of the modified Wang resin, three model peptides were resigned and synthesized, and cleaved by 3-pyridinecarboxaldehyde sulfonium salt. The results showed that the peptides with side chain fully protected could be obtained by using the modified Wang resin, and could also be preliminary applied to the synthesis of long-chain peptides.
自20世纪60年代以来, 多肽固相合成(SPPS)已取得突飞猛进的发展[1], 随着长链困难肽和小蛋白领域的研究越来越受到关注[2], 固相合成中合成长度受限[3]、 产率和纯度不高[4]、 困难序列难以合成[5]及成本昂贵[6]等诸多问题已成为人们关注的热点. 研究发现, 通过合成侧链全保护肽可以特异地连接活性基团, 从而降低副反应、 延长肽链或得到特异性结构[7, 8], 此途径是合成长肽、 困难肽的新方法[2, 9]. 合成侧链全保护肽的关键在于树脂的选择[10]. 目前, 基于得到侧链全保护肽片段的理念, 已设计出一些新型树脂[11], 如2-氯三苯甲基氯树脂(CTC树脂)[12]可以合成侧链全保护肽, 尤其是在合成环肽上有很好的效果. 但文献[13]研究结果表明, CTC树脂会在酸性缩合剂存在的情况下发生裂解[12], 过夜反应中产物损近60%.
基于合成侧链全保护肽的目的选择树脂, 关键在于树脂把手(Linker)的选择[14]. 把手的功能基团将决定随后组装目标化合物的反应类型、 保护基形式及最后的裂解反应类型[15]. 首先, 把手的引入使多肽与把手形成的键比原来的苄酯键更稳定[16, 17]. 其次, 把手上基团的电子效应可以调节肽链与载体形成的化学键对酸、 碱及光照等切割条件的敏感度, 避免接肽过程中肽链的过早脱落及切割反应中使用强酸引起的副反应, 以期获得完全自由或部分保护的肽片段. 再次, 把手的空间隔离作用在相当程度上增加了肽链与载体的相容性, 有利于缩合反应的进行[17].
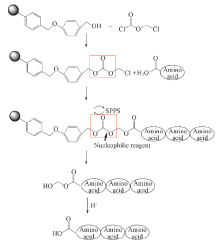
本文基于碳酸酯结构易于亲核脱除的原理, 对目前广泛使用且价格便宜的Wang树脂进行改构, 设计了一种氯甲基碳酸酯型把手. 氯甲基碳酸酯的把手可将羟基型树脂变为氯甲基型树脂, 使其连接效率更高, 同时碳酸酯的结构可以在强亲核、 弱碱条件下裂解而侧链保护基不受影响, 实现了获得侧链全保护肽片段的目的[18]. 在此基础上, 采用合成的系列侧链全保护肽片段, 通过片段缩合得到长肽(见Scheme 1), 突破了固相肽合成中存在的难题.
改构树脂运用到肽链的合成中, 关键在于3个方面: (1) 树脂可以与首位氨基酸连接; (2) 树脂在反应过程中能稳定存在; (3) 反应结束后可以将目标产物温和裂解并保证侧链保护基不受影响. 制得改构树脂后, 对其性能进行了研究. 通过9-芴甲氧羰基(Fmoc)浓度标准曲线探究了改构树脂与20种Fmoc保护氨基酸的首位连接效率, 并进行了条件优化. 另外, 综合考虑实验效果、 侧链保护情况和合成时间等因素, 初步设计合成了3种模型肽: (1) Fmoc-Ile-Phe-Gly(P1), 无侧链保护基, 可以验证改构树脂合成、 裂解肽链的方法; (2) Boc-Lys(Z)-Ala-Asn(Trt)-OH(P2), 只有两端的氨基酸有侧链保护基, 因为多肽两端的氨基酸更容易在把手裂解时受影响; (3) Fmoc-Thr(tBu)-Glu(OtBu)-Lys(Z)(P3), 3个氨基酸分别带有— OH, — NH2和 — COOH侧链保护基. 3个模型肽的设计各有侧重, 即无侧链保护、 两端侧链保护和侧链全保护, 从3个层面验证新把手的适应性. 在3个模型肽中, 包含了多肽固相合成中常用的6个侧链保护基: Fmoc, Boc, tBu, OtBu, Trt和Z. 通过3个模型肽的合成和裂解反应验证了新型把手与常用侧链保护基的兼容性, 其中Fmoc在碱性条件下易脱除, 而亲核性的肟盐类裂解试剂本质上也是一种弱碱, Fmoc基团在裂解时能否稳定存在, 对新型把手的性能评价至关重要. 通过对其进行合成和裂解, 可以判断基于改构树脂能否得到侧链全保护的多肽.
Fmoc-氨基酸(纯度96%)和Wang树脂(负载量1.1 mmol/g)购于上海吉尔生化有限公司; 氯甲酸氯甲酯购于萨恩化学技术公司; 碳酸铯、 3-吡啶甲醛和一水合氢氧化铯购于多点化学试剂公司; 二氯甲烷(DCM)、 N, N-二甲基甲酰胺(DMF)和哌啶等试剂购于上海国药集团化学试剂有限公司; 实验室用水为纯水或超纯水. 实验所用试剂均为分析纯.
SHKE2000型高性能摇床(美国Barnestad International公司); Heidolph 4600型旋转蒸发仪(德国Heidolph公司); JA-N2103N型电子天平(上海民桥精密科学仪器有限公司); UV-754型紫外分光光度计(上海紫一试剂厂); Synthware P130010C型多肽合成管和P120025C型多肽合成管(北京欣维尔玻璃仪器公司); LCMSD-1100型液相色谱-质谱仪(美国Agilent公司).
经过前期模拟实验研究, 选取吡啶作为敷酸剂, 利用氯甲酸氯甲酯改构Wang树脂, 并确定最优反应条件. 称取1 g(1.2 mmol/g) Wang树脂置于三口瓶中, 加入15 mL DCM, 缓慢搅拌溶胀2 h; 将89 μ L(1 mmol)氯甲酸氯甲酯和96 μ L(1.2 mmol)吡啶分别溶于5 mL DCM中, 缓慢滴入三口瓶中, 冰浴下缓慢搅拌反应4 h. 反应过程中需注意反应体系保证无水干燥, 并定时用DCM冲洗瓶壁上的树脂, 保证完全反应.
反应结束后, 将反应液移入固相反应器中, 依次用DMF, DCM和DMF间隔洗涤4次后, 真空干燥过夜(12 h), 得到产物1.089 g, 产率96.7%. 利用下式计算得到改构树脂的取代度(SD1).
式中, 产率Y(%)=m2/
改构树脂与首位氨基酸的连接效率取决于氨基酸种类、 树脂取代度和反应时间等因素. 将改构树脂利用铯盐法连接首位氨基酸, 利用Fmoc浓度法计算氨基酸的上载率[8].
Fmoc浓度工作曲线的绘制: 取17 mg(0.05 mmol)氨基Fmoc保护的缬氨酸(Fmoc-Val-OH), 加入1 mL体积分数为20%的哌啶/DMF溶液, 置于摇床上反应30 min. 反应结束后, 用无水甲醇定容至50 mL, 再稀释10倍. 分别取稀释后的溶液1, 2, 3, 4, 5, 6, 7, 8和9 mL定容至10 mL配成系列浓度梯度的标准溶液. 标准溶液分别与空白对照, 测定其在301 nm处的紫外吸收值. 吸光度与浓度数据如表1所示.
| Table 1 Concentration-absorbance data of Fmoc |
改构树脂与Fmoc氨基酸连接: 先用甲醇和N, N-二异丙基乙胺(DIEA)封闭改构树脂未改构的位点. 取0.05 mmol封闭后的改构树脂加入5 mL DCM中, 置于摇床上溶胀2 h; 取0.2 mmol氨基酸溶于无水甲醇中, 加入0.15 mmol CS2CO3超声反应5 min, 生成氨基酸的碳酸铯盐; 旋转蒸发除去溶剂, 用5 mL DMF复溶, 将其加入到改构树脂中, 于摇床上反应2 h, 重复加料反应1次. 反应结束后, 加入1 mL体积分数为20%的哌啶/DMF, 于摇床上裂解30 min. 分离出裂解液定容至50 mL, 再稀释10倍得到样品. 将体积分数为20%的哌啶/DMF溶液稀释500倍作为空白样品, 于301 nm波长下测定样品的吸光度值.
根据测得的吸光度值计算首位氨基酸连接率[c(%)]:
式中: cFmoc为由Fmoc标准曲线计算得到的Fmoc浓度; 500为稀释倍数; SD1为改构后树脂的取代度. 对20种氨基酸按照上述方法分别进行实验并计算结果.
为测试改构树脂的效果, 运用固相合成法合成了3种模型肽P1, P2和P3.
1.4.1 模型肽的合成 改构前、 后的Wang树脂的活性基团不同, 故首位氨基酸上载的方式随之变化. 经过模拟实验的探索, 确定采用铯盐法上载首位氨基酸[16], 即将氨基酸与碳酸铯反应生成氨基酸铯盐, 再与把手反应从而连接到树脂上.
由于P1, P2和P3的合成方法相似, 故选择Fmoc-Ile-Phe-Gly-O-Linker(P1)为例描述其合成: 将0.5 g(1.065 mmol/g)改构树脂置于25 mL多肽合成器中, 加入DCM溶胀2 h, 抽滤DCM洗涤3次. 取654.1 g(2.2 mmol)甘氨酸(Fmoc-Gly-OH)充分溶解于20 mL甲醇中, 加入(1 mmol 0.325 g) CS2CO3后立即有气泡产生, 超声5 min至反应完全. 将氨基酸铯盐溶液减压蒸除溶剂后, 用20 mL DMF溶解, 加入固相反应器中, 于摇床上反应2 h后, 重复加料1次. 反应结束后, 抽除反应液, 用DMF和甲醇间隔洗涤树脂3次. 加入10 mL 20%哌啶/DMF溶液脱除Gly保护基, 分别反应10和20 min各1次, 抽滤, 依次用DMF, DCM和DMF各10 mL交替洗涤3次. 用毛细管沾取少量树脂进行Kaiser检测, 于100 ℃油浴中加热5 min, 发现树脂变蓝, 证明第一个氨基酸成功偶联.
后续氨基酸按照Fmoc法的一般方法接入: 取0.778 g苯丙氨酸(Fmoc-Phe-OH)、 0.568 g(0.15 mmol)苯并三氮唑-N, N, N, N-四甲基异脲六氟化磷(HBTU)、 0.203 g(0.15 mmol)1-羟基苯并三唑(HOBT), 溶于20 mL DMF中, 加入0.49 mL(0.15 mmol)DIEA活化5 min后, 加入固相反应器中, 于摇床上反应2 h. 偶联结束后, 除去溶剂, 依次用DMF, DCM和DMF各10 mL交替洗涤3次. 用毛细管沾取少量树脂进行Kaiser检测, 直至不变蓝确定反应完全. 脱保护后, 采用同样的方法接入第3个氨基酸.
1.4.2 模型肽的裂解 以合成侧链全保护的肽片段为目的, 参照文献[19]方法使用温和型裂解剂3-吡啶甲醛肟铯盐裂解改构树脂.
3-吡啶甲醛肟的制备: 将3.213 g(30 mmol)3-吡啶甲醛和3.129 g(45 mmol)盐酸羟胺溶于50 mL水中, 加入3.690 g(45 mmol)乙酸钠, 室温下搅拌1 h. 停止反应后, 静置0.5 h, 过滤, 用滤液洗涤滤饼2次. 将滤液置于冰箱中冷藏3 h后, 再次过滤, 合并2次滤饼, 经干燥得3.384 g产物, 产率92.2%.
3-吡啶甲醛肟铯盐的制备: 将2.085 g(17 mmol)3-吡啶甲醛充分溶解于50 mL甲醇中, 加2.722 g(17 mmol)入氢氧化铯, 油浴下回流反应4 h. 反应结束后, 冷却至室温, 过滤, 得到淡黄色固体, 干燥后称重为4.380 g, 产率97%.
模型肽的裂解: 取508 mg 3-吡啶甲醛肟铯盐加入30 mL DMF中, 超声溶解制成浓度为0.1 mmol/L的裂解液(pH=8). 分别取5 mL裂解液, 加入500 mg干燥的P1, P2和P3中, 常温下搅拌12 h. 将反应液分别抽滤至锥形瓶中, 滤液用柠檬酸调节pH=6, 静置10 min后, 用乙酸乙酯萃取3次, 饱和食盐水洗涤3次, 用无水硫酸钠干燥过夜; 过滤除去干燥剂, 减压蒸除溶剂得到粗品肽. 对粗品肽用高效液相色谱(HPLC)纯化, 色谱条件: 梯度洗脱, 流速2 mL/min, V(甲醇)∶ V(水)=70∶ 30. 用紫外检测仪在301 nm处检测Fmoc基团, 收集出峰产品, 进行液相色谱-质谱检测.
将20种常见氨基酸分别按照上述方法与改构树脂反应3次, 计算连接率并取平均值, 结果列于表2. 可见, 改构把手均可用于20种氨基酸. 通过与文献[20]报道的Wang树脂与首位氨基酸的连接率进行比较, 可得到以下结论: (1) 氯甲基碳酸酯改构树脂和Wang树脂在与氨基酸连接时均主要受到氨基酸侧链基团大小的影响, 侧链基团越大, 空间位阻较大, 连接率下降. (2) Wang树脂与部分氨基酸的连接效率非常低, 尤其是侧链基团较大的Arg, 连接率仅为52%, 但此类氨基酸改构把手的连接率高于与Wang树脂的连接率. 这是因为改构后的树脂连接了氯甲基碳酸酯的把手, 把手越长, 相当于拓宽了化学反应的空间, 与氨基酸反应的空间位阻相应减小, 对于位阻较大的氨基酸更有利. (3) 甲基氯与羧基反应效率大于羟基与羧基的反应, 因此总体上氯甲基碳酸酯把手树脂与保护氨基酸的连接效率更高, 但对于部分氨基酸, 其氨基酸的铯盐在DMF中的溶解度有限, 导致连接效率降低, 例如His.
| Table 2 Connection rate of modified resin to 20 kinds of amino acids |
对于连接效率较低的精氨酸, 针对树脂取代度和反应时间等因素进行了优化实验, 结果如表3所示. 可见, 随着取代度的降低, 侧链基团较大的氨基酸与改构树脂的连接率增高, 结合肽合成实际综合考虑, 确定取代度约0.4 mmol/g为最优条件. 同时, 随着反应时间的延长, 连接率先上升后趋于平稳, 因此确定最优时间为3 h.
| Table 3 Effects of resin substitution degree and reaction time on connection rate |
经过模型肽的合成和裂解, 对得到的目标肽进过了HPLC纯化和液相色谱-质谱检测. 结果表明, P1的相对分子量为557.6368, 峰位置m/z 557, 对应产物为Fmoc-Ile-Phe-Gly-OH; P2的相对分子量为527.6108, 峰位置m/z 530.9, 对应产物为Boc-Lys(Z)-Ala-Asn(Trt)-OH+Na+; P3的相对分子量为845.0213, 峰位置m/z 844.4, 对应产物为Fmoc-Thr(tBu)-Glu(OtBu)-Lys(Z)-OH. 由此可确认, 在合成过程中改构树脂能够在弱碱性亲核裂解剂的作用下得到侧链全保护的肽片段.
利用氯甲酸氯甲酯改构Wang树脂, 进一步采用碳酸铯盐法将改构后的树脂与20种常用的Fmoc氨基酸进行首位连接, 在较小的树脂取代度和较长的反应时间下, 均能获得70%以上的连接率. 结果表明, 改构后的树脂可以用于固相多肽合成. 通过3种不同模型肽的设计、 合成和裂解反应, 验证了改构树脂能够合成侧链全保护的肽片段, 为长链困难肽的合成提供了一种新的技术和方法.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|