联系人简介: 周 敏, 男, 博士, 副教授, 主要从事天然药物化学方面的研究. E-mail: zhouminynun@163.com; 江志勇, 男, 博士, 教授, 主要从事天然药物化学方面的研究. E-mail: jiangzy2010@163.com
采用多种色谱分离方法从柳叶五层龙( Salacia cochinchinensis Lour)的茎叶中分离得到5个化合物. 通过一维(1D)及二维核磁共振波谱(2D NMR), 包括核磁共振氢谱(1H NMR)、 核磁共振碳谱(13C NMR)、 异核单量子相关(HSQC)、 异核多键相关(HMBC)、 氢氢相关(1H-1H COSY)和旋转坐标中的欧沃豪斯增强光谱(ROESY), 以及红外光谱(IR)和电喷雾电离高分辨质谱(ESI-HRMS)等方法, 鉴定其结构分别为Salaciacochinoside A(1), 5'- O-3,4,5-trimethoxybenzoyl- β- D-apiofuranoside(2), 5-methoxy-anticerol A(3), 21 α,30-dihydroxy-D∶A-friedooleanan-3-one(4)和21 α,26-dihydroxyfriedelan-3-one(5). 化合物1~3为新化合物. α-葡萄糖苷酶抑制活性测试结果显示, 化合物1和3对 α-葡萄糖苷酶具有显著的抑制作用, 其IC50值分别为0.32和0.59 μmol/L; 化合物2, 4和5未表现出 α-葡萄糖苷酶抑制活性.
Five compounds were isolated from the stems and leaves of Salacia cochinchinensis Lour. By comprehensive spectroscopic analyses including mass spectroscopy(MS), infrared radiation(IR), 1D and 2D nuclear magnetic resonance(NMR) [heteronuclear single quantum coherence(HSQC), heteronuclear multiple bond correlation(HMBC),1H-1H chemical-shift correlation spectroscopy(1H-1H COSY) and rotating frame overhauser effect spectroscopy(ROESY)], their structures were elucidated as Salaciacochinoside A(1), 5'- O-3,4,5-trimethoxybenzoyl- β- D-apiofuranoside(2), 5-methoxy-anticerol A(3), 21 α,30-dihydroxy-D∶A-friedooleanan-3-one(4) and 21 α,26-dihydroxyfriedelan-3-one(5), respectively. Compounds 1—3 were new compounds. All the compounds were assayed for the anti-diabetic activities. Compounds 1 and 3 exhibited remarkable bioactivity, inhibiting α-glucosidase with IC50 values of 0.32 and 0.59 μmol/L, respectively. Compounds 2, 4 and 5 showed none anti-diabetic activity in current experiment.
植物或真菌次级代谢产物中的化合物是药物及其先导化合物的重要来源[1, 2], 也是近年来我国药物学家关注的重点. 研究发现, 五层龙属植物中柳叶五层龙茎叶的乙醇提取物具有较好的α -葡萄糖苷酶抑制活性[3]. 柳叶五层龙(Salacia cochinchinensis Lour)为灌木, 高达2米, 主要产于云南西双版纳, 越南和柬埔寨也有分布. 五层龙属植物的化学成分主要包括木栓烷型三萜[4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20]、 降碳醌甲基型五环三萜[5]、 羽扇豆烷型五环三萜[9]、 齐墩果烷型五环三萜[18]等三萜类化合物和四环三萜[10]、 降倍半萜[21]、 黄酮[22]以及锍盐[23]等类型的化合物. 生物活性研究结果显示, 其中的部分化合物有细胞保护[15]及α -葡萄糖苷酶抑制[12, 20]等活性. 迄今, 尚未见关于柳叶五层龙化学成分的报道. 为了从中寻找高效低毒的降糖活性成分, 本文对前期筛选有良好α -葡萄糖苷酶抑制作用的S. cochinchinensis进行了活性成分研究, 从中分离得到5个化合物(1~5), 包括3个新化合物(1~3)和2个已知化合物(化合物4: 21α , 30-dihydroxy-D∶ A-friedooleanan-3-one[19]和化合物5: 21α , 26-dihydroxyfriedelan-3-one[8]). 对这些化合物进行了α -葡萄糖苷酶抑制活性研究, 发现化合物1和3对α -葡萄糖苷酶有显著抑制作用, 其IC50值分别为0.32和0.59 μ mol/L; 化合物2, 4和5未表现出α -葡萄糖苷酶抑制活性.
α -葡萄糖苷酶(上海宝曼生物科技有限公司); 阿卡波糖(Acarbose, 纯度99%, Sigma公司); 高效液相色谱仪使用色谱纯甲醇(德国默克公司)和娃哈哈纯净水; 其余试剂为工业纯, 经二次重蒸处理.
Bruker AVANCEⅢ 400 MHz核磁共振波谱仪(瑞士Bruker公司); 岛津UPLC-IT-TOF质谱仪(日本岛津公司); Agilent 1260型半制备高效液相色谱仪(HPLC, 美国安捷伦科技公司); Shimadza shim-pack GIS色谱柱(日本岛津公司); C18柱层析硅胶(德国默克公司); 柱层析硅胶和GF254薄层色谱硅胶(青岛海洋化工厂).
1.2.1 提取和分离 柳叶五层龙茎叶部分(10.0 kg)于2013年9月采自西双版纳, 经中国科学院西双版纳热带植物园周仕顺博士鉴定为柳叶五层龙(S. cochinchinensis Lour).
将干燥的柳叶五层龙茎叶粉碎后, 用8倍质量的90%(体积分数)乙醇溶液回流提取3次, 每次2 h, 合并提取液并浓缩得浸膏1.78 kg. 将浸膏混悬于适量水中, 依次用石油醚、 乙酸乙酯及正丁醇萃取, 分别得到石油醚浸膏200 g、 乙酸乙酯浸膏230 g、 正丁醇浸膏250 g和水相浸膏180 g. 将正丁醇萃取部分浸膏250 g用100~200目硅胶进行柱色谱分离, 以氯仿/甲醇/水(体积比95∶ 5∶ 0~80∶ 20∶ 2)梯度洗脱, 得到6个组分Fr.1~Fr.6.
取组分Fr.3样品3.6 g以氯仿/丙酮(体积比1.5∶ 1~1∶ 1)为流动相进行硅胶柱色谱分离, 经薄层色谱(TLC)检测合并后得到组分Fr.3-1, Fr.3-2和Fr.3-3, 其中Fr.3-1(737.0 g)经HPLC以甲醇/水(体积比30∶ 70)作流动相反复制备得到化合物1(15.0 mg, tR=31.0 min).
将组分Fr.6(34.8 g)以乙酸乙酯/甲醇(体积比95∶ 5~8∶ 2)为流动相进行硅胶柱色谱分离, 得到组分Fr.6-1(3.0 g)和Fr.6-2(29.6 g). 将组分Fr.6-1以氯仿/甲醇/水(体积比90∶ 10∶ 1)为流动相进行硅胶柱色谱分离, 得到组分Fr.6-1-1(200 mg), 将组分Fr.6-1-1进一步以氯仿/甲醇(体积比95∶ 5)为流动相进行硅胶柱色谱分离, 得到组分Fr.6-1-1-1(70 mg), 再经HPLC以甲醇/水(体积比26∶ 74)为流动相制备得到化合物2(17.0 mg, tR=46.0 min).
取组分Fr.4样品6.3 g在C18柱色谱中以甲醇/水(体积比55∶ 45~100∶ 0)为流动相分离, 得到组分Fr.4-1(732 mg)和Fr.4-2(597 mg). 将组分Fr.4-1以氯仿/丙酮(体积比2∶ 1~1∶ 1)为流动相, 通过硅胶柱色谱分离得到组分Fr.4-1-1(100 mg)和Fr.4-1-2(160 mg). 将组分Fr.4-1-1经HPLC纯化, 以甲醇/水(体积比63∶ 37)为流动相制得化合物4(23 mg, tR=21.3 min)和5(11 mg, tR=26.3 min). 将组分Fr.4-1-2经HPLC以甲醇/水(体积比18∶ 82)为流动相制得到化合物3(5.8 mg, tR=10.0 min).
1.2.2 α -葡萄糖苷酶抑制活性测试 以阿卡波糖(Acarbose)为阳性对照, 参照文献[24]报道的96孔板2倍稀释法, 测试了化合物1~5的α -葡萄糖苷酶抑制作用(IC50值). 实验分为空白组、 对照组、 样品空白组和样品组. 将各组样品按照不同剂量在96孔板中加样, 每组3个平行, 依次加入50 μ L 0.01 mol/L PBS缓冲液(pH=6.8)、 20 μ L不同浓度样品溶液和40 μ L底物(对硝基苯酚α -葡萄糖苷, PNPG, 2 mmol/L), 混合均匀后, 于37 ℃水浴中保温10 min; 然后加入经37 ℃水浴的α -葡萄糖苷酶充分混合均匀, 于37 ℃水浴反应20 min后, 加入150 μ L 0.2 mol/L的Na2CO3溶液终止反应. 由于PNPG在α -葡萄糖苷酶作用下水解成对硝基苯酚(PNP)和葡萄糖, PNP在405 nm处有最大吸收, 故采用分光光度法测定405 nm处的吸光度. 根据下式计算抑制率(I)及IC50值:
化合物1为白色无定形粉末, 易溶于甲醇. 其ESI-MS(+)谱在m/z 395[M+Na]+处出现准分子离子峰, ESI-HRMS(+)(C17H24O9Na+计算值), m/z: 395.1316(395.1313)[M+Na]+, 确定其分子式为C17H24O9, 不饱和度为6. 化合物1的IR谱在3434, 1601, 1498, 1451和1067 cm-1处出现吸收峰, 提示其结构中存在— OH、 芳环及苷键等官能团. 化合物1的1H NMR谱(见表1)在低场δ H 6.85(2H, s, 2, 6-H)处观察到2个单峰芳氢质子信号, 同时在δ H 4.76(1H, d, J=7.7 Hz, 1'-H)处出现1组糖的端基质子信号, 根据其偶合常数分析为β -构型连接. 此外, 在δ H 4.02(6H, s, 3, 5-MeO)处出现了2个单峰甲氧基质子信号. 化合物1的13C NMR谱(见表1)中观察到17个碳信号, 包括1组β -D-吡喃葡萄糖的6个碳信号及完全重叠的2个甲氧基碳信号δ 56.9(q, 3, 5-MeO). 综合上述波谱数据分析, 推断化合物1中存在1, 3, 4, 5取代的芳环, 同时2个甲氧基处于对称位置. 将化合物1的波谱数据与已知化合物Ficuscarpanoside B[25]比较, 发现两者的氢谱和碳谱数据较相似, 不同之处在于化合物1比Ficuscarpanoside B多1个甲基信号, 少1个与氧相连的亚甲基信号.
| Table 1 1H NMR(CD3OD, 400 MHz) and 13C NMR(CD3OD, 100 MHz) data of compounds 1— 3 |
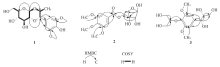
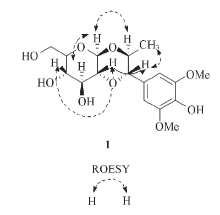
为进一步确定化合物1比Ficuscarpanoside B多出的甲基所连接的位置, 测定了化合物1的2D NMR相关谱图. 在其HMBC谱(图1)中观察到7-H(δ H 4.30, d, J=9.1 Hz, 1H)和8-H(δ H 4.06, m, 1H)与9-Me(δ C 17.4, q)有明显的相关信号, 此外还在1H-1H COSY谱(图1)中观察到8-H/9-H的相关信号, 推测化合物1中多出的甲基(9-Me)与C8相连. 化合物1的相对立体构型通过其ROESY相关进行了确证. 在化合物1的ROESY谱(图2)中, 可观察到9-Me与7-H相关, 7-H与2'-H相关, 8-H与1'-H相关, 推测9-Me与7-H, 2'-H在同侧(β 位), 而8-H与1'-H处在同侧(α 位). 上述构型推测合理地解释了7-H偶合常数较大[δ H 4.30(d, J=9.1 Hz)]的现象.
其它HMBC和 1H-1H COSY的相关结果(见图1)进一步证实了化合物1的结构. 综合上述分析, 推测化合物1的结构如图3所示, 命名为Salaciacochinoside A(1).
化合物2为白色无定形粉末, 易溶于甲醇. 其ESI-MS(+)谱在m/z 367[M+Na]+处出现准分子离子峰, ESI-HRMS(+)(C15H20O9Na+计算值), m/z: 367.0998(367.1000) [M+Na]+; IR谱在3424, 1656, 1600, 1498, 1460和1013 cm-1处出现吸收峰, 提示化合物2中存在— OH、 芳环、 共轭酯羰基及C— O键等官能团. 化合物1的1H NMR谱(见表1)中低场δ H 7.35(2H, s, 2, 6-H)处出现2个完全重合的单峰芳氢质子信号, 同时在δ H 4.87(1H, d, J=2.6 Hz, 1'-H)处出现1个糖的端基质子信号, 此外在δ H 3.89(6H, s, 3, 5-MeO)和δ H 3.38(3H, s, 4-MeO)处出现3个单峰甲氧基质子信号(其中2个完全重叠). 化合物1的13C NMR谱(见表1)中出现15个碳信号, 包括6个季碳(其中1个C=O), 4个— CH(其中2个完全重叠), 2个— CH2和3个甲氧基(其中2个完全重叠). 分析化合物2的NMR谱图可知, 该化合物为酚类成分衍生物, 且含有1个对称的四取代芳环结构. 将化合物2的波谱数据与5'-O-3, 4-methoxy-benzoyl-β -D-apiofuranoside[26]比较, 发现2个化合物的糖部分波谱数据极为相近, 提示化合物2中亦存在1个β -D呋喃芹糖单元. 不同之处在于化合物2比5'-O-3, 4-methoxy-benzoyl-β -D-apiofuranoside的芳环部分多1个甲氧基信号.
为了进一步确定该甲氧基的取代位置, 测定了化合物2的2D NMR相关谱图. 在其HMBC谱中(图1), 可观察到3个甲氧基分别与C3, C4和C5明显相关, 提示化合物2中多出的1个甲氧基连接于C5位. 此外, 其HMBC谱中还观察到2-H, 6-H与C7相关, 芹糖单元的5'-H与C7相关, 进一步证实C7与芳环上C1和芹糖的C5'连接. 综合上述波谱分析, 推测化合物2的结构如图3所示, 命名为5'-O-3, 4, 5-trimethoxybenzoyl-β -D-apiofuranoside(2).
化合物3为白色无定形粉末. 根据ESI-HRMS(C14H22O8Na+计算值), m/z: 3421.1207(341.1212)[M+Na]+, 确定其分子式为C14H22O8, 不饱和度为4. 化合物3的1H NMR谱(表1)中出现2个芳氢(δ H 6.76, s, 2H, 2, 6-H) 和2个甲氧基质子信号(δ H 3.86, s, 6H, 3, 5-MeO), 提示分子中存在对称取代的芳环结构; 其13C NMR谱(表1)中有14个碳信号, 包括4个季碳、 3个亚甲基、 5个次甲基和2个甲氧基. 将化合物3的波谱数据与Anticerol A[27]比较, 发现两者的非芳环部分数据十分相近, 不同之处在于化合物3的芳环上多出1个甲氧基取代. 根据其氢谱分析, 化合物3中存在对称取代的芳环, 推测其多出的甲氧基处于C5位. 该推测在其HMBC谱图(图1)中得到证实, δ H 3.86(6H, 3, 5-MeO) 与δ C 154.6(C3, C5)HMBC相关, 表明C3, C5位与甲氧基相连. 其它HMBC和 1H-1H COSY谱图(图1)相关结果进一步证实了对化合物3的结构推测. 综合以上分析, 推测化合物3的结构如图3所示, 命名为5-methoxy anticerol A.
分别测试了化合物1~5对α -葡萄糖苷酶的抑制活性, 结果(表2)表明, 化合物1和3对α -葡萄糖苷酶有显著的抑制作用, 其IC50值分别为0.32和0.59 μ mol/L, 化合物2, 4和5未表现出α -葡萄糖苷酶抑制活性.
| Table 2 α -Glucosidase inhibitory activities of compounds 1— 5 |
从柳叶五层龙茎叶的90%(体积分数)乙醇水溶液提取物的正丁醇萃取部分中分离得到5个化合物, 通过现代波谱学分析, 结合文献对比鉴定了其结构, 其中化合物1~3为新化合物. 初步的α -葡萄糖苷酶抑制活性实验结果表明, 化合物1和3表现出良好的α -葡萄糖苷酶抑制活性, 提示有必要开展进一步的活性成分研究.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|