联系人简介: 何 峰, 男, 博士, 副教授, 主要从事微生物、 植物资源挖掘与开发方面的研究. E-mail: hfeng@hust.edu.cn
利用发酵法对阿舒假囊酵母进行发酵, 用萃取法和水蒸气蒸馏法从发酵液中提取精油; 通过气相色谱-质谱(GC-MS)法确定其成分; 分别利用抑菌圈和二倍稀释法实验法测定了精油的抗真菌能力、 最小抑菌浓度和最小杀菌浓度; 利用荧光标记法、 精油处理酵母后细胞内容物检测法及透射电子显微镜研究了精油的抗菌机理. 结果表明, 阿舒假囊酵母发酵法得到的精油产率为0.54 g/L. 用GC-MS法鉴定了22种化学成分, 占精油总量的98.82%. 精油主要由单萜、 倍半萜、 芳香醇和倍半萜烃类物质组成. 精油对白色念珠菌、 光滑念珠菌、 热带念珠菌、 季也蒙念珠菌、 新型隐球菌和酿酒酵母具有良好的抗菌活性, 其最小抑菌浓度分别为31.25, 31.25, 62.5, 31.25, 15.625和15.625 μg/mL; 最小杀菌浓度分别为62.5, 62.5, 125.0, 62.5, 31.25和31.25 μg/mL. 结果表明, 精油的抗菌机理可能是破坏真菌的细胞壁、 细胞膜, 使胞内物质外泄, 最终导致真菌死亡. 该研究结果为发酵法合成精油及其应用提供了新思路.
The essential oil was obtained from the broth of Eremothecium ashbyii H4565 by solvent extraction and steam distillation. The chemical components of essential oil were investigated by gas chromatography-mass(GC-MS) spectrometry. Antifungal activities were studied by inhibition zone method. Two fold dilution method was used to determine the minimum inhibitory concentration(MIC) and minimum bactericidal concentration(MBC). Cytoplasmic membrane permeability, protein and potassium ion leakage, and transmission electron microscope were used to determine antifungal mechanism. The results showed that the yield of essential oil was 0.54 g/L. Twenty two compounds, about 98.82% constituents of the total, were identified by GC-MS analysis. The essential oil was composed mainly of monoterpenes, sesquiterpenes, aromatic alcohol, and sesquiterpene hydrocarbons. The essential oil exhibited strong antibacterial activities against C. albicans, C. guilliermondii, C. tropicalis, C. glabrata, C. neoformans and S. cerevisiae. The MIC of the essential oil against these microorganisms were 31.25, 31.25, 62.5, 31.25, 15.625 and 15.625 μg/mL, respectively. The MBC of the essential oil against these microorganisms were 62.5, 62.5, 125.0, 62.5, 31.25 and 31.25 μg/mL, respectively. Based on analyses of cytoplasmic membrane permeability, protein and potassium ion leakage and transmission electron microscope, the possible targets of the essential oil were cell wall and cytoplasmic membrane. The results showed a new light on development and application of the essential oil from microorganism.
人类真菌感染性疾病主要分为浅部真菌病、 皮下真菌病和深部真菌病[1]. 深部真菌病也称系统性真菌病, 深部真菌的病原菌侵犯内脏器官和血液骨骼系统导致的危害性极大, 病死率较高[2]. 在深部真菌病患者体内经常发现一些条件致病病原真菌, 如白色念珠菌、 新型隐球菌及酵母菌等[3]. 这些真菌在过去几十年中逐渐被认为是人类感染的重要致病菌, 尤其是免疫功能低下的患者, 如器官移植受者、 艾滋病患者和癌症患者. 因此, 由真菌引起的侵袭性感染被认为是人类第4大死因[4].
近年来, 来源于植物的精油及其抗真菌活性受到广泛关注. 如百里香精油对念珠菌、 隐球菌曲霉菌和皮肤癣菌均有较强的抑制作用[5]; 月桂精油对念珠菌有强烈的抑制作用[6]; 从迷迭香叶子中提取的精油能抑制轮枝样镰刀菌的生长[7]. 但受到季节、 气候等地理条件的影响, 导致精油的产量较低、 成本较高, 在工业化生产与应用中受到限制. 利用微生物发酵的方法制备精油因可避免上述问题而受到重视, 如利用发酵法生产β -苯乙醇和香兰素等重要的香料物质[8, 9]. 但是, β -苯乙醇和香兰素等均为微生物发酵产生的结构单一性物质.
阿舒假囊酵母(Eremothecium ashbyii)是一种产子囊孢子并利用子囊孢子进行繁殖的酵母菌株, 一直被应用于工业化发酵生产核黄素[10, 11]. 本课题组在利用阿舒假囊酵母进行核黄素发酵时, 发现其尾气具有类似于玫瑰精油的香味. 因此, 开展了对阿舒假囊酵母合成芳香物质的研究. 本文通过发酵阿舒假囊酵母生物合成了一种由多组分物质构成的精油, 确定了其化学组成; 研究了精油的抗菌活性、 最小抗菌浓度(MIC)和最小杀菌浓度(MBC); 探讨了其抗菌机理, 为微生物发酵法合成精油及应用提供了新思路.
阿舒假囊酵母Eremothecium ashbyii H4565(E. ashbyii H4565)从大别山土壤中分离, 由中国典型培养物保藏中心鉴定并保存(保藏编号为CCTCC No.M2015655); 抗真菌实验所用的指示菌分别为白色念珠菌(Candida albicans ATCC10231, C. albicans)、 光滑念珠菌(Candida glabrata ATCC90030, C. glabrata)、 热带念珠菌(Candida tropicalis ATCC 13803, C. tropicalis)、 季也蒙念珠菌(Candida guilliermondii ATCC 6260, C. guilliermondii)新型隐球菌(Cryptococcus neoformans ATCC 90112, C. neoformans)和酿酒酵母(Saccharomyces cerevisiae ATCC 9763, S. cerevisiae), 均保存于黄冈师范学院经济林木种质改良与资源综合利用湖北省重点实验室; 荧光染料3, 5-二丙基硫羰花青 (diSC35) 购于美国Molecular Probes 公司; 两性霉素B购于美国Sigma公司; 实验所用生化试剂均为分析纯, 购于国药控股股份有限公司.
BioBench 30L SIP型发酵罐(荷兰Applikon公司); 5975C-7890A型气相色谱-质谱联用仪(GC-MS, 美国 Agilent公司); H-7000FA型100 kV透射电子显微镜(TEM, 日本Hitachi公司); FP-6500型荧光光谱仪(日本Jasco公司); Spectr AA 220型原子吸收光谱仪(美国Varian公司).
将E. ashbyii H4565菌种接种到马铃薯葡萄糖琼脂固体培养基(PDA)上活化. 按照质量体积分数配制各种培养基, 组成为20%马铃薯(煮汁)+2%葡萄糖+2%琼脂. 将活化的种子接种到种子培养基中, 于28 ℃培养36 h. 种子培养基的组成: 1%酵母膏+2%蛋白胨+2%葡萄糖, 灭菌后pH=6.8~7.0. 将种子液以10%接种量接种至发酵罐中培养. 发酵培养基的组成: 5%蔗糖+2%豆粕粉+1.2%酵母粉+0.2%磷酸二氢钾+0.05%硫酸镁, 灭菌后pH=6.8~7.0. 发酵结束后, 取5 L发酵液, 用正己烷萃取, 每次萃取时正己烷的添加量为5 L, 重复3次, 萃取结束后, 合并全部有机相, 在35 ℃下减压蒸馏至无正己烷馏出, 得到精油粗品; 然后采用水蒸气蒸馏设备对精油粗品进行蒸馏, 馏出部分经冷凝后得到油水混合物. 将油水混合物以10000 r/min的转速离心20 min, 进行油水分离. 收集油层并用无水硫酸钠干燥, 得到精油.
精油的组分采用气相色谱-质谱联用(GC-MS)法测定[12, 13], 利用仪器自带的NIST08谱库检索各组分对应物质的结构.
为了进一步确认各组分的正确性, 参照文献[14]方法计算各组分的线性保留指数(RI), 并与文献[15]报道的这些物质的RI值进行比较, 最终确定精油的组分.
各组分的含量根据其在气相色谱中的峰面积, 采用归一法计算. RI的计算公式如下:
式中: n为正构烷烃的碳原子数; tx, tn和 tn+1分别为待测物质、 含有n个和n+1个碳原子对应的正构烷烃在气相色谱中的保留时间.
采用抑菌圈实验测定了精油的抗菌能力.
液体培养基组成: 200 g马铃薯(煮汁)+20 g葡萄糖+1000 mL蒸馏水, 分装后灭菌备用.
固体培养基组成: 在液体培养基中加入质量体积分数为1.5%的琼脂, 分装后灭菌备用.
将指示菌白色念珠菌、 光滑念珠菌、 热带念珠菌、 季也蒙念珠菌、 新型隐球菌和酿酒酵母分别接种于已灭菌的液体培养基中, 于28 ℃培养36 h.
分别取0.2 mL上述6种指示菌置于装有固体培养基的平皿表面上, 用三角涂棒将其涂布均匀, 用打孔器在培养皿中央打孔(孔直径为4 mm). 用正己烷将精油配制成浓度约为50 μ g/mL的样品, 取待测样品0.1 mL置于孔中, 将培养皿置于28 ℃培养箱中培养48 h后, 测量抑菌圈直径. 两性霉素B(Amphotericin B)是一种具有广谱性的多烯类抗真菌药物, 采用50 μ g/mL两性霉素B作为阳性对照, 正己烷为阴性对照, 每种菌做3个平行实验.
采用二倍稀释法测定了精油的最小抑菌浓度(MIC)和最小杀菌浓度(MBC)[16, 17]. 将配制好的液体培养基分装至试管中, 第1支试管加入4 mL, 其它每支试管加入2 mL, 每11支为一组, 分别标记为1~11号, 灭菌后备用. 取4 mg精油置于每组第1支试管中, 摇匀后取2 mL加入第2支试管中, 如此减半稀释直至第9支试管, 形成1000, 500, 250, 125, 62.5, 31.25, 15.625, 7.825和3.4125 μ g/mL的浓度梯度. 第10支试管为阴性对照, 不加样品只加指示菌液和正己烷; 第11支试管为空白对照, 不加样品只加指示菌液. 然后, 在各组试管中分别加入0.2 mL指示菌白色念珠菌、 光滑念珠菌、 热带念珠菌、 季也蒙念珠菌、 新型隐球菌和酿酒酵母, 各种菌液的接种浓度均约为107 cfu/mL. 最后, 将试管置于28 ℃摇床中培养48 h后观察, 指示菌完全不生长的试管对应精油的最小浓度即为该菌的MIC值. 分别取未见指示菌生长的试管中的溶液0.2 mL置于灭菌的PDA平皿上, 用三角涂棒涂布均匀, 指示菌完全不生长的平皿对应精油的最小浓度即为该菌的MBC值.
酿酒酵母作为与人类关系最密切的一种酵母, 通常是无毒无害的, 但在临床某些疾病, 如鹅口疮、 阴道炎和败血症患者身上能发现酿酒酵母. 因此, 本文采用酿酒酵母为研究对象.
1.6.1 荧光标记法测定精油对酵母细胞膜的破坏作用 参照文献[18, 19]方法, 采用荧光标记法测定不同浓度精油对酵母细胞膜的破坏作用, 以正己烷作为对照.
1.6.2 精油对酵母细胞的破坏作用 参照文献[20]方法, 通过检测经不同浓度精油处理酿酒酵母后的溶液中蛋白质浓度的变化, 确定精油对酵母细胞的破坏作用. 同时, 参照文献[21]方法, 通过检测经不同浓度精油处理酿酒酵母后的溶液中钾离子浓度的变化, 确定精油对酵母细胞的破坏作用, 以正己烷作为对照.
1.6.3 利用透射电子显微镜(TEM)观察精油对酵母细胞的破坏作用 参照文献[22]方法, 利用透射电子显微镜观察经精油处理酿酒酵母后细胞的破坏情况. 取少量酿酒酵母菌液置于Eppendorf管中, 用磷酸盐缓冲溶液洗涤5次, 加入精油使其终浓度为50 μ g/mL, 将酵母菌液和精油混合均匀, 于30 ℃孵育30 min后离心, 将得到的菌体用30 mg/mL的戊二醛固定24 h, 进行超薄切片, 将切片置于透射电子显微镜下观察精油对酵母细胞的破坏情况.
将5 L发酵液用正己烷萃取获得9.0 g精油粗品, 再利用水蒸气蒸馏法进行蒸馏, 获得2.7 g精油, 产率为0.54 g/L.
精油的化学组成分析结果列于表1, 采用GC-MS法分析并鉴定了22种化学成分, 占精油总量的98.82%. 结果表明, 精油主要由单萜、 倍半萜、 芳香醇和倍半萜烃类物质组成. 其中, 单萜类物质中香叶醇(36.58%)含量最高, 其次是香茅醇(34.43%)和芳樟醇(5.30%); 倍半萜类物质有橙花叔醇(4.56%); 芳香醇类物质有苯乙醇(5.39%); 萜烯类物质中长叶烯(4.22%)含量最高, 其次为石竹烯(1.77%)和罗汉柏烯(1.11%).
| Table 1 Components of the essential oil |
参照玫瑰精油国际标准ISO 9842: 2003, 玫瑰精油主要由香叶醇、 香茅醇、 芳樟醇和β -苯乙醇组成. 从阿舒假囊酵母生物合成的精油组分可知, 其主要组分也含有香叶醇、 香茅醇、 芳樟醇和β -苯乙醇, 与国际标准ISO 9842: 2003类似, 但同时含有长叶烯和石竹烯等烯类物质, 说明阿舒假囊酵母合成的精油与天然玫瑰精油具有一定的差别.
抑菌圈大小可用于判断物质抗菌能力的大小, 抑菌圈直径超过20 mm, 则认为该物质具有较强的抗菌能力[23]. 精油的抗真菌活性测定结果如表2所示, 6种受试真菌的抑菌圈直径均超过25 mm, 特别是对新型隐球菌和酿酒酵母的抑菌圈直径超过了30 mm, 说明精油对受试真菌均有强烈抑制作用. 与阳性对照药物两性霉素B相比, 二者对白色念珠菌、 光滑念珠菌、 热带念珠菌和季也蒙念珠菌的抑菌圈大小相仿; 两性霉素B对新型隐球菌的抑制能力明显强于精油; 而精油对酿酒酵母的抑制能力略强于两性霉素B. 来源于阿舒假囊酵母的精油含有大量香叶醇、 香茅醇、 芳樟醇和β -苯乙醇, 这可能是精油具有抗菌活性的原因.
| Table 2 Antifungal activities of the essential oil |
由表2还可见, MIC和MBC测定结果与抑菌圈实验结果一致, MIC和MBC越小的菌株对应的抑菌圈直径越大.
2.4.1 精油对荧光标记的酵母细胞膜的破坏 亲脂性羰花青荧光染料diSC35进入细胞后与细胞膜结合, 不能发出荧光. 当有药物作用于该细胞, 破坏细胞膜时, diSC35就从细胞膜上脱落, 引起荧光值增大. 因此, 可以通过荧光值变化测定药物对细胞膜的破坏情况, 从而确定药物的作用靶点是否为细胞膜[24]. 精油对酵母细胞膜的破坏作用如图1所示.
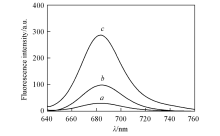 | Fig.1 Permeabilisation of S. cerevisiae cytoplasmic membranes treated by the essential oil a. Control; b. MIC; c. MBC. |
图1曲线a~c分别为正己烷及浓度为MIC和MBC的精油作用于荧光标记的酵母时荧光值变化曲线. 与正己烷对照相比, 精油作用于利用荧光标记的酵母细胞膜后, 荧光值发生明显变化, 说明精油破坏了酵母细胞膜, 导致羰花青荧光染料diSC35从细胞膜脱落, 引起荧光值增大. 而且, 精油浓度越大, 荧光值越高, 说明高浓度精油对酵母的破坏作用越强. 利用不同浓度的精油处理用diSC35标记的酵母后, 其荧光值大幅增加, 表明其细胞膜受到了破坏, 也说明细胞膜可能是精油作用于酵母的靶点之一.
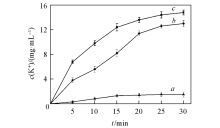
2.4.2 精油处理酿酒酵母后胞外蛋白质的含量 用精油处理酵母菌后, 溶液中可溶性蛋白质的变化情况如图2所示. 可见, 用MIC浓度的精油处理酵母时, 溶液中可溶性蛋白质含量在10 min后开始迅速增加, 在25 min时达到最大值(730 μ g/mL). 用MBC浓度的精油处理酵母时, 在5 min后溶液中可溶性蛋白质含量开始快速增加, 在20 min时达到最大值(760 μ g/mL). 而对照组(即正己烷)处理酵母时溶液中可溶性蛋白质含量基本不变. 结果表明, 精油在极短时间内能够破坏酵母的细胞结构, 导致细胞内可溶性蛋白泄露到细胞外.
 | Fig.2 Effect of the essential oil on the water soluble protein of S. cerevisiae a. Control; b. MIC; c. MBC. |
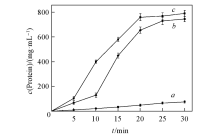
2.4.3 精油处理酿酒酵母后胞外钾离子的含量 与蛋白质的情况类似, 利用精油处理酵母菌后, 溶液中钾离子含量的变化情况如图3所示.
可见, 用MIC浓度的精油处理酵母时, 溶液中钾离子含量在0~20 min内快速增加, 在20 min后缓慢增加, 在30 min时达到最大值(13.0 μ g/mL). 用MBC浓度的精油处理酵母时, 在0~5 min内溶液中钾离子含量快速增加, 在20 min后接近最大值(14.8 μ g/mL). 而对照组(即正己烷)处理酵母时溶液中钾离子含量基本不变. 实验结果进一步证实, 精油在极短时间内能够破坏酵母细胞, 导致细胞内钾离子泄露到细胞外.
用不同精油处理酵母后, 引起蛋白质与钾离子的泄露, 说明精油能破坏酵母的细胞壁和细胞膜, 即酵母的细胞壁和细胞膜可能是精油的作用靶点. 这可能是因为精油的各种组分均为非极性的, 在与酵母接触过程中易于插入酵母的脂质双分子层内, 使细胞破裂, 细胞内容物外泄, 导致细胞死亡. 这也是精油处理酵母后的溶液中很快能检测出蛋白质与钾离子的原因.
2.4.4 精油对酵母细胞破坏作用的TEM观察 用精油处理酵母后细胞结构的透射电子显微镜照片如图4所示.
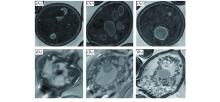 | Fig.4 TEM images of S. cerevisiae (A1)— (A3) Control; (B1)— (B3) S. cerevisiae treated by the essential oil. |
由图4(A)可见, 未处理的酵母细胞规整, 细胞壁、 细胞膜完整且清晰可见, 胞内物质致密均匀, 未发生皱缩和破裂. 由图4(B)可见, 经精油处理后, 酵母细胞壁变得疏松, 出现大面积破裂; 细胞膜也发生破裂; 胞内物质密度不均匀, 分布较分散, 可见大小不一的空泡, 内容物有外泄趋势. 此结果表明, 精油能破坏酵母的细胞壁和细胞膜, 导致胞内物质外泄, 最终导致菌体解体死亡. 细胞壁和细胞膜均被精油破坏, 进一步说明细胞壁和细胞膜可能是精油作用于酵母的靶点之一.
制备了一种来源于阿舒假囊酵母的含有多种组分的精油, 其对白色念珠菌、 光滑念珠菌、 热带念珠菌、 季也蒙念珠菌、 新型隐球菌及酿酒酵母等真菌具有显著的抗菌活性. 研究结果表明, 精油的抗菌机理可能是同时破坏了真菌的细胞壁和细胞膜, 导致细胞内物质如蛋白质和钾离子的泄露, 最终导致细胞死亡.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|