联系人简介: 王际辉, 男, 博士, 教授, 博士生导师, 主要从事天然活性物质的开发及活性方面的研究.E-mail: wangjh_dlpu@163.com;耿旭辉, 男, 博士, 副研究员, 主要从事高灵敏光学传感器方面的研究. E-mail: xuhuigeng@126.com
采用时间分辨荧光技术, 检测了不同形态蛋白聚集体的荧光染料硫磺素T(ThT)荧光寿命. 利用蛋清溶菌酶体外制备了蛋白聚集体; 采用透射电子显微镜(TEM)及ThT稳态荧光检测了结合蛋白纤维生长的动力学曲线, 确定其形成寡聚体及纤维样聚集体的特征和时间. 通过时间相关单光子计数(TCSPC)技术测定了蛋清溶菌酶单体、 寡聚体和淀粉样纤维的ThT荧光寿命曲线, 并拟合、 计算其荧光寿命. 根据圆二色谱(CD)分析结果推测聚集体的结构不同导致其与ThT的结合状态不同, 从而影响ThT荧光寿命. 结果表明, 通过测定ThT荧光寿命可以区分蛋白单体、 寡聚体和纤维样聚集体, 并监测蛋白寡聚体的形成, 为后续病理蛋白聚集过程中形成寡聚体物质的监测提供了研究基础.
Thioflavin T(ThT) fluorescence lifetime was used to detect aggregates states by time-resolved fluorescence. The protein aggregation was made by the egg white lysozyme in vitro. The characteristics of the oligomer and fibril were determined by means of transmission electron microscopy, ThT steady-state fluorescence and the growth kinetic curve of aggregation. The time-correlated single-photon counting technique was used to measure the fluorescence lifetime of ThT incubation with the aggregations. It calculated the fluorescence lifetime by fitting to the double exponential equation. The results of circular dichroism speculated that the structure of different aggregates was different and affected the fluorescence lifetime of ThT. It demonstrated that ThT fluorescence lifetime can distinguish protein monomers, oligomers and fibrils, and monitor the formation of protein oligomers. The results provide a basis for the monitoring of oligomer substances in the proess of sub-sequent pathological protein aggregation.
许多神经退行性疾病(NDs), 如帕金森病(PD)、 阿尔茨海默病(AD)和肌萎缩性脊髓侧索硬化症(ALS)等, 均与神经细胞内病理蛋白质的淀粉样纤维化(Fibril)密切相关[1, 2]. 淀粉样纤维是指发生错误折叠的蛋白质形成的一类由β 折叠片构成的丝状蛋白聚集体[3, 4]. 机体内淀粉样纤维形成的斑块沉积长期被认为是导致一系列神经退行性疾病的根本原因[3]. 然而, 研究发现, 当将鸡溶菌酶蛋白的寡聚体注射到小鼠脑内时, 小鼠会出现神经退行性疾病的表症; 而注射了成熟的纤维后, 小鼠几乎无相关的损害和毒性[5]. 因此可认为, 蛋白质错误折叠时, 在聚集进程的前期形成的可溶性蛋白质“ 寡聚体” 物质是导致神经退行性疾病发生的根本原因. 寡聚体通常是指由几个到几十个蛋白质单体形成的聚集体物质, 是淀粉样纤维聚集体的核体物质.
对于寡聚体的检测, 多集中于特异性抗体物质的制备或酶联免疫吸附测定(ELISA)等[6]. 但这些检测手段对操作人员的技术及操作平台要求很高, 难以大范围推广和应用. 因此, 探索及时检测蛋白质错误折叠的寡聚体的常规技术, 对深入了解神经退行性疾病的病理机制非常重要, 对相关疾病的早期诊断也具有重要价值.
荧光物质的荧光寿命与自身的结构、 所处微环境的极性及黏度等条件有关, 因此利用荧光寿命可以直接了解研究如超分子体系中分子间的簇集、 蛋白质高级结构等的体系变化. 目前, 常用荧光染料硫磺素T(ThT)的稳态荧光光谱检测、 鉴定蛋白质在体外形成的纤维聚集体以及原位、 组织学标本中的纤维[7]. ThT在不同溶液中的荧光寿命具有明显的差异[8]. 因此, 可利用时间分辨荧光技术检测不同形态蛋白聚集体的ThT荧光寿命, 以区分蛋白单体、 寡聚体和纤维样聚集体, 并监测蛋白在聚集过程中形成的寡聚体物质.
淀粉样纤维化是许多疾病病变蛋白的共性. 溶菌酶也是具有淀粉样纤维倾向的蛋白质之一, 因此溶菌酶蛋白经常被作为体外蛋白质纤维化研究的模型[9]. 本文选择蛋清溶菌酶作为研究对象, 通过强变性体系制备了蛋清溶菌酶的纤维样聚集体. 利用透射电子显微镜(TEM)检测了蛋清溶菌酶在不同孵育时间形成聚集体的状态; 结合ThT稳态荧光蛋白聚集的生长情况, 确定了蛋清溶菌酶在实验条件下形成寡聚体和纤维的时间段; 利用时间分辨荧光测量技术, 对蛋清溶菌酶单体、 寡聚体和淀粉样纤维的ThT荧光寿命进行了检测; 通过三阶公式, 计算得出与不同状态聚集体结合的ThT的荧光寿命. 结果表明, 不同状态聚集体的ThT荧光寿命具有明显差异. 进一步利用圆二色谱(CD)对不同蛋白聚集体的二级结构进行了检测, 推测ThT与寡聚体及纤维均可结合, 但由于其不同聚集体的结构不同, 导致ThT与聚集体结合的程度和方位不同, 因此不同状态聚集体的ThT荧光寿命明显不同. 此结果为后续病理蛋白聚集过程中寡聚体物质的监测提供了相关的研究基础.
蛋清溶菌酶(Lysozyme, egg white, Mw=14300)购于Amresco公司; 荧光染料硫磺素T(ThT)和醋酸双氧釉购于Sigma公司; 400目普通碳膜铜网购于中镜科仪公司; 叠氮化钠、 盐酸、 磷酸氢二钠、 磷酸二氢钠及Tris-盐酸缓冲液等均为分析纯, 购于索莱宝(北京)公司.
UV-2550 Probe型紫外分光光度计(日本岛津公司); LS-55型荧光分光光度计(美国Perkin-Elmer公司); LifeSpec Ⅱ 型荧光寿命光谱仪(英国Edinburgh Instruments公司); JEM-2100(UHR)型透射扫描电子显微镜(日本电子公司); Jasco MOS450型圆二色光谱仪(CD, 英国Applied Photophysics公司); EPL-405皮秒脉冲二极管激光器(英国Edinburgh Instruments 公司), 脉冲宽度 86 ps, 此波长下仪器响应函数434.0 ps; 实验用水均由Milli-Q系统制备.
1.2.1 蛋清溶菌酶聚集体的制备 以10 mmol/L盐酸(pH=2.0)为溶剂配制20 mg/mL的蛋清溶菌酶溶液. 将蛋白样品置于65 ℃的水浴锅内孵育, 参照文献[9, 10]方法制备蛋白聚集体. 制备过程中, 在蛋白液中加入质量分数为0.05%的叠氮化钠, 以防止微生物污染. 每隔一定时间取样, 并于4 ℃保存待测; 剩余样品继续孵育制备聚集体.
1.2.2 透射电子显微镜(TEM)表征蛋清溶菌酶聚集体形态 将适量待测蛋清溶菌酶聚集体样品稀释至0.5 mg/mL, 参照文献[11]方法, 利用透射电子显微镜, 以80 kV电压, 在放大8万倍的条件下, 观察蛋清溶菌酶蛋白在不同孵育时间时产生的聚集体的形态.
1.2.3 蛋清溶菌酶聚集的ThT荧光光谱检测 用20 mmol/L磷酸盐缓冲液(pH=7.4)配制终浓度为2.5 mmol/L的ThT荧光染料的储备液, 用滤膜(0.22 μ m)过滤除去菌体及杂质后, 于4 ℃避光保存, 待用. 取50 μ L蛋清溶菌酶聚集体待测样品, 加入2.9 mL Tris-HCl缓冲液(10 mmol/L, pH=8.0)和30 μ L ThT母液, 然后涡旋振荡30 s, 避光静置30 min. 首先, 采用荧光分光光度计检测与蛋白聚集体结合的ThT的荧光光谱, 确定其最大激发与发射波长; 进而检测不同蛋白聚集体的ThT荧光发射情况[12, 13]. 实验中设置激发波长为440 nm(狭缝为10 nm), 发射波长为484 nm(狭缝为5 nm).
1.2.4 聚集体ThT荧光寿命的时间分辨荧光技术检测 采用具有时间相关单光子计数(TCSPC)技术的LifeSpec Ⅱ 型荧光光谱仪测定了蛋清溶菌酶单体、 寡聚体和淀粉样纤维聚集体的荧光寿命[14, 15]. 设定激发波长为405 nm, 工作重复频率10 MHz. 通过F900数据采集处理软件(Edinburg Instruments Ltd.)采集数据. 对荧光寿命数据采用Origin9.0软件利用二阶指数方程进行拟合, 并最终求得ThT荧光寿命的均值.
1.2.5 蛋清溶菌酶聚集体二级结构的圆二色光谱(CD)分析 将孵育不同时间的蛋清溶菌酶聚集体样品用Tris-HCl缓冲液稀释, 使其终浓度为0.1 mg/mL. 将样品加入CD谱的比色皿中(宽度为1 mm), 在室温及190~260 nm波长下扫描蛋白溶液的CD谱[16].
利用TEM观察了蛋清溶菌酶孵育不同时间时产生的聚集体的形态. 溶菌酶蛋白在变性去折叠的条件(如强酸、 高温及还原环境等)下, 能够形成淀粉样纤维化聚集体. 在pH=2.0, 65 ℃水浴条件下, 制备了蛋清溶菌酶的聚集体, 选取不同孵育时间的样品, 检测了蛋白的聚集情况.
由图1可见, 与未经处理的空白对照组相比, 实验条件下孵育1 d时, 蛋清溶菌酶出现了较为规则的球状蛋白聚集体, 平均直径为18~80 nm. 每个蛋清溶菌酶蛋白单体的直径约为4.5 nm, 由此推算, 每个颗粒状聚集体由4~18个蛋白单体构成, 其相对分子质量为58000~260000[图1(B)]. 孵育2 d时, 聚集体的体积增大, 形态由初期的球形变成了不规则的聚集体, 并初步具有类线性形态的聚集体[图1(C)]. 孵育4 d时, 聚集体逐渐增大, 出现了部分类纤维的聚集结构[图1(D)]. 孵育6 d时, 蛋白寡聚体基本消失, 出现了短小的典型纤维丝结构, 其直径为8~15 nm, 纤维丝长度为0.3~1.5 nm[图1(E)]. 孵育9 d时, 蛋清溶菌酶蛋白已经形成了较长的纤维丝[图1(F)]. 由于蛋白分子之间结合尚不紧密, 所以此时纤维丝粗细不均, 结构较松散, 中空形态不够立体化. 随着孵育时间的继续延长(12~20 d), 纤维聚集体的结构逐渐至成熟状态, 其形态规则、 均一、 细长且无分支[图1(G)~(I)].
上述结果表明, 蛋清溶菌酶在实验条件下会形成典型的淀粉样纤维聚集体. 在聚集过程中, 蛋白由最初的寡聚体形成核体, 逐渐聚集延伸后, 形成纤维样的聚集体.
目前, 常用ThT检测蛋白的纤维聚集体. ThT作为分子转子[17, 18], 当稀溶液中游离的ThT分子被激发时, 由于中央碳键的旋转作用, 其处于激发态的分子可以通过非辐射通道快速地弛豫回基态(见图2), 因此不会发出荧光.
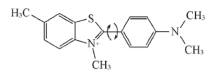 | Fig.2 Chemical structure of thioflavin-T Arrows showing rotational movement around the central carbon bond. |
但是, ThT能与淀粉样纤维侧链之间的“ 沟渠” 位置结合, 由于结合部位的几何约束, 限制了其中央碳键的快速旋转, 导致其通过C— C单键旋转的非辐射态回归过程被抑制, 只能通过辐射荧光回到基态. 因此, ThT与淀粉样纤维结合后, 会被激发产生明显的发射荧光. 根据TEM表征结果, 测定了蛋清溶菌酶纤维样聚集体(孵育第16 d的样品)的发射光谱. 结果显示, 在440 nm波长的激发下, 与蛋白纤维聚集体结合的ThT在480 nm处出现最大发射峰. 因此, 在后续的荧光实验中选取440 nm波长激发, 均以480 nm波长发射的条件检测蛋白聚集体的ThT的荧光情况.
ThT的稳态荧光光谱常用来表征蛋白淀粉样聚集体的产生[12, 13, 19]. 图3(A)和(B)分别展示了不同蛋清溶菌酶聚集体的ThT稳态荧光光谱及其纤维生长的动力学曲线. 结果表明, 在孵育0~2 d时, 在480 nm处ThT无发射峰, 尽管此时蛋白已经形成了寡聚体[图1(C)]. 孵育第4 d的样品在480 nm处出现明显的ThT荧光峰. 随着孵育时间的延长, 蛋白聚集体ThT的荧光强度逐渐增强. 孵育第9 d时, ThT荧光达到并稳定在较高的水平(9~20 d), 此时, 蛋清溶菌酶蛋白聚集体为成熟的淀粉样聚集体[图1(F)~(I)]. 上述结果表明, 利用ThT的稳态荧光可以监测蛋白的淀粉样纤维聚集体, 但不能监测蛋白在聚集前期形成的寡聚体.
ThT的荧光寿命与其结构、 所处微环境的极性及黏度等条件有关. 因此, 通过荧光寿命可以直接了解物质体系周围环境发生的微观变化[20]. 利用时间分辨荧光技术检测了蛋清溶菌酶不同形态聚集体的ThT荧光寿命. 利用高重复频率的皮秒脉冲激光器激发(激发波长405 nm), 同时选取发射谱中强度最大处作为荧光衰减过程的检测波长. 此类荧光物质的荧光衰减过程往往呈现出多指数方程的衰减特性, 图4展示了蛋清溶菌酶蛋白单体(孵育0 d)、 寡聚体(孵育2 d)和纤维聚集体(孵育16 d)的荧光寿命动力学曲线.
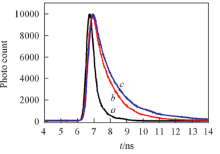 | Fig.4 Fluorescence emission decay curves of ThT incubation with the samples of the egg lysozyme Incubation time/d: a. 0; b. 2; c. 16. |
利用二阶指数方程对不同孵育时间的蛋白聚集体的荧光寿命进行拟合[21], 计算得出相应样品的ThT荧光寿命(见表1). 结果表明, 单体蛋白的荧光寿命时间很短(τ =0.5 ns). 荧光光谱结果表明, ThT不能与单体蛋白结合, 被激发后也不会产生发射荧光, 因此单体蛋白样品内的ThT无荧光寿命(图4谱线a). 孵育2 d时蛋白寡聚体的ThT具有明显的荧光寿命(图4谱线b), 其寿命为1.06 ns, 约为蛋白单体ThT寿命的2.0倍. 这表明虽然利用荧光光谱技术无法检测蛋白寡聚体, 但利用ThT的荧光寿命可以检测到寡聚体的形成, 从而区分蛋白单体与寡聚体. 纤维样蛋白聚集体的荧光寿命也明显长于寡聚体(图4谱线c), 计算其ThT的荧光寿命约1.50~1.60 ns, 约为寡聚体寿命的1.5倍. 上述结果表明, 利用时间分辨荧光技术检测ThT的荧光寿命可以区分蛋白单体、 寡聚体及纤维样聚集体.
| Table 1 Kinetic analysis of emission decay for ThT in the presence of egg lysozyme aggregation samples for different incubation time* |
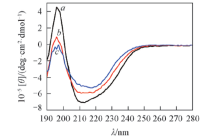
不同状态蛋白聚集体的ThT荧光寿命不同, 可能是由于蛋白寡聚体和纤维聚集体的二级结构不同, 从而导致其与ThT的结合状态不同. CD技术常用于检测蛋白大分子的二级结构[16, 22].
由图5可知, 天然溶菌酶在210~215 nm处有最低椭圆率, 在196 nm正峰处具有最高椭圆率, 表明溶菌酶的天然结构主要以α 螺旋为主. 对于孵育2 d的寡聚体样品, 负峰位置红移至215 nm, 表明溶菌酶淀粉样纤维的构象正在由主要的螺旋转变为β 折叠. 孵育16 d的蛋白聚集体, 负峰的位置主要处于216 nm, 即蛋白的纤维样聚集体以β 折叠为主. CD谱结果说明, 3种状态蛋白的二级结构明显不同, 导致其与ThT结合的位置及其结合部位的局部物理化学环境不同, 进而对ThT分子的中心自旋旋转影响不同, 造成蛋白单体、 寡聚体以及纤维的ThT荧光衰变的寿命不同.
利用时间分辨荧光技术检测了不同状态蛋白聚集体的ThT荧光寿命. 结果表明, 基于ThT的荧光寿命可区分具有不同聚集状态的寡聚体、 淀粉样纤维和单体, 从而监测蛋白寡聚体的形成. 本文结果为后续病理蛋白聚集过程中寡聚体物质的监测提供了相关的研究基础.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|