联系人简介: 魏永巨, 男, 博士, 教授, 主要从事天然荧光产物和荧光分析方面的研究. E-mail: weiyju@126.com
研究了黄豆黄素和黄豆黄苷在不同pH条件下的吸收光谱和荧光光谱, 从分子结构的角度解释了二者呈现不同光谱特征的原因. 黄豆黄素分子基本无荧光. 在弱碱性时, 黄豆黄素分子发生7-OH质子的电离, 导致吸收光谱中320 nm的吸收峰红移至348 nm. 采用pH-光度法测得7-OH质子的电离常数p Ka1=7.08±0.04. 黄豆黄素一价阴离子呈现较强荧光, 最大激发和发射波长 λex/ λem分别为334 nm/464 nm, 荧光量子产率为0.049. 在碱性溶液中, 黄豆黄素4'-OH质子电离, 导致吸收光谱中254 nm的吸收峰红移至260 nm, 电离常数p Ka2=9.96±0.01. 黄豆黄苷分子基本无荧光. 在碱性条件下, 黄豆黄苷分子的4'-OH质子发生电离, 导致吸收光谱中256 nm的吸收峰红移至 280 nm, 电离常数p Ka=9.81±0.03. 黄豆黄苷阴离子基本无荧光, 但在热碱性条件下发生 γ-吡喃酮环裂解反应而产生较强荧光, λex/ λem为288 nm/388 nm, 裂解产物的荧光量子产率为0.056. 虽然, 黄豆黄苷与黄豆黄素是苷与苷元的关系, 但黄豆黄苷不能在热碱性条件下通过糖苷水解转变为黄豆黄素, 二者的荧光增强机理存在本质不同.
The absorption and fluorescence spectra of glycitein and glycitin in aqueous solutions with different pH values were investigated in detail, and the reasons why the two presented different spectral characteristics were explained in the viewpoint of molecular structure. The molecular form of glycitein is essentially no fluorescence. Under weak alkaline condition, the 7-OH proton ionization causes a redshift of the absorbance peak at 320 nm to 348 nm. The proton ionization constant is measured to be p Ka1=7.08±0.04, by a pH-photometric method. The univalent-anion form of glycitein exhibit a fairly strong fluorescence with maximum excitation and emission wavelengths( λex/ λem) of 334 nm/464 nm, and the fluorescence quantum yield is measured to be 0.049. In alkaline solutions, the ionization of 4'-OH proton of glycitein causes a redshift of the absorbance peak at 254 nm to 260 nm, the ionization constant is p Ka2=9.96±0.01. The molecular form of glycitin has almost no fluorescence. Under alkaline conditions, the ionization of 4'-OH proton causes a redshift of the absorbance peak at 256 nm to 280 nm, with p Ka=9.81±0.03. The anion form of glycitin has almost no fluorescence, but the cleavage reaction of γ-pyrone ketone ring occurs under hot and alkaline conditions and produces a fairly strong fluorescence, with λex/ λem of 288 nm/388 nm, and the fluorescence quantum yield of the cleavage reaction product is 0.056. Although the relationship between glycitin and glycitein is as that of glycoside and aglycone, but glycitin cannot be converted to glycitein by means of hydrolysis of glycoside under hot alkaline conditions. The fluorescence enhancement mechanisms of these two are essentially different.
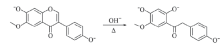
异黄酮类化合物是一类由异黄酮(3-苯基色原酮)衍生出来的化合物, 在食物和药物中广泛存在, 是许多中药的活性成分. 黄豆黄素(Glycitein)和黄豆黄苷(Glycitin)是一对(苷元和苷)异黄酮类化合物(结构见图1), 存在于花生[1]、 大豆[2]、 葛根的花[3]、 淡豆鼓[4]和血脂康胶囊[5]等食品或药物中, 具有抗肿瘤[6]、 降血脂[7, 8]、 改善心肌缺血[9]、 抗炎[10]和预防糖尿病[11]等药理作用. 黄豆黄素和黄豆黄苷在中药或生化样品中的含量通常采用薄层色谱[12]、 液相色谱结合紫外检测器等方法测定[13, 14, 15, 16]. 异黄酮类化合物分子结构中含有共轭刚性结构, 能够吸收紫外-可见光且可能在适当条件下产生荧光. 但是, 关于黄豆黄素和黄豆黄苷吸收光谱和荧光光谱的系统研究迄今未见报道.
我们在实验中发现, 黄豆黄素可以在弱碱性条件下产生荧光, 而黄豆黄苷只能在碱性条件下经过加热产生荧光. 二者的分子结构相似, 但荧光性质却有很大差异. 本文对二者的吸光和荧光性质进行了深入研究, 侧重考察了水溶液pH值对二者吸收光谱和荧光光谱的影响, 研究了在热碱性条件下发生的γ -吡喃酮环裂解反应和氧苷键水解反应及其相应的光谱变化, 通过综合比较二者的吸收光谱和荧光光谱, 解释了二者在各种实验条件下可能的存在形态(分子型体、 离子型体、 裂解或水解产物)及其呈现不同光谱特征的分子结构原因. 本文为建立二者的荧光分析方法奠定了基础, 也为研究其它异黄酮类化合物的荧光性质提供了参考.
黄豆黄素(Glycitein, 批号: AW079G, 纯度98.2%)购自天津一方科技有限公司, 黄豆黄苷(Glycitin, 批号: DST170420-008, 纯度99.5%)购自成都德思特生物技术有限公司, 分别用甲醇(HPLC 级, 美国Tedia公司)配制成一定浓度的标准溶液, 置于4 ℃冰箱中备用. Britton-Robinson缓冲溶液: 将磷酸、 硼酸和乙酸混合溶液(浓度均为0.20 mol/L)与NaOH溶液(1.0 mol/L)以一定比例混合, 用于调节pH值; 硫酸奎宁(生化试剂, 上海试剂二厂), 以0.05 mol/L的硫酸溶液配制成1.00× 10-5 mol/L溶液. 所用酸碱试剂均为分析纯或优级纯; 实验用水为二次去离子水, 经检测无荧光.
F-7000型荧光分光光度计(日本Hitachi公司), 配备150 W氙灯, 1 cm荧光池, UV-29和UV-31型滤光片, 激发和发射狭缝宽为5.0 nm, 光电倍增管负高压为700 V; UV-2501PC型紫外-可见分光光度计(日本Shimadzu公司), 1 cm吸收池; 828型pH/ISE测试仪(芬兰Orion公司).
pH值对吸光和荧光影响的测定: 在一系列10 mL容量瓶中分别加入黄豆黄素或黄豆黄苷溶液, 以缓冲溶液调节不同的pH值, 用水定容, 摇匀, 扫描其吸收光谱或荧光光谱; 或者把一系列不同pH值的黄豆黄苷溶液加热一定时间, 冷却至室温, 定容, 摇匀, 扫描其荧光光谱.
溶剂对荧光影响的测定: 在一系列10 mL容量瓶中, 分别加入黄豆黄素溶液和不同体积的甲醇, 以水定容, 摇匀, 扫描其荧光光谱并测定荧光强度.
温度对荧光的影响: 在一系列10 mL容量瓶中加入黄豆黄苷溶液和2.0 mL 1.0 mol/L的NaOH溶液, 分别在室温(约20 ℃), 40, 50, 60, 70, 80, 90和100 ℃水浴中加热一定时间, 冷却至室温, 定容, 扫描其荧光光谱.
加热时间对荧光影响的测定: 在一系列10 mL容量瓶中加入黄豆黄苷溶液和2.0 mL 1.0 mol/L 的NaOH溶液, 在100 ℃水浴中加热, 每隔10 min取一瓶溶液冷却至室温, 以水定容, 扫描其荧光光谱, 考察加热时间对荧光的影响.
荧光量子产率测定: 在25 mL容量瓶中加入适量硫酸奎宁溶液, 以0.05 mol/L H2SO4溶液定容, 摇匀; 扫描其紫外吸收光谱和荧光光谱, 测定激发波长处的吸光度和积分荧光强度, 以硫酸奎宁在313 nm激发波长下的荧光量子产率(0. 55)为参比, 计算待测物质的荧光量子产率[17].
考察了黄豆黄素水溶液在不同pH值下的吸收光谱, 结果如图2所示. 在pH< 4.8时, 黄豆黄素在波长254和320 nm附近有弱的吸收峰. 随着pH值升高, 254 nm处吸光度增大, 吸收峰位置基本不变, 同时, 320 nm吸光度增大且吸收峰逐步红移至348 nm[图2(A)], 吸光度随着pH值的变化呈现质子电离时常见的S形曲线[图2(B)]. 由图1可知, 黄豆黄素分子结构中包含7-OH和4'-OH, 属于二元有机弱酸, 其中7-OH较易电离. 图2(A)所示的光谱变化对应于7-OH质子的电离, 带负电荷的氧离子的供电子作用大于羟基, 使分子的共轭程度增大, 吸光能力增强. 由于各波长下吸光系数均增大, 故图2(A)中无等色点出现. 当pH> 8.6后, 随着pH值升高, 254 nm吸收峰红移, 波长小于260 nm的吸光度降低, 波长大于260 nm的吸光度升高, 在260 nm 处形成等色点[图2(C)], 238 nm处吸光度随着pH值的变化呈倒S形曲线[图2(D)], 这一光谱变化对应于4'-OH质子的电离. 黄豆黄素的质子电离过程如Scheme 1所示.
 | Fig.2 Absorption spectra of glycitein aqueous solutions at different pH values(A, C) and the relationship between absorbance and pH value(B, D) |
 | Scheme 1 Proton dissociation reaction of glycitein Volume fraction of MeOH: 10%. (B) 6.56 μ g/mL, 254 nm; (D) 6.76 μ g/mL, 238 nm. |
根据图2中的光谱数据, 可以用pH-光度法分步(按一元酸)计算黄豆黄素分子中2个羟基质子的电离常数. 计算公式[18]如下:
式中: AHL表示弱酸分子全部以HL型体存在时的吸光度[图2(B)中pH=4.8附近的A值]; AL表示弱酸分子全部以L型体存在时吸光度[图2(B)中pH=8.6附近的A值]. 将图2(B)中的 pH-A数据(为减小实验误差对计算结果的影响, 一般采用位于S曲线中间部分的实验点)代入式(1), 计算得到黄豆黄素7-OH质子的电离常数, 结果列于表1. 表1中4个实验点计算结果的平均值为pKa1=7.08± 0.04. 类似地, 依据图2(D)中的pH-A数据, 计算得到黄豆黄素4'-OH质子的电离常数, 结果列于表2. 表中4个实验点计算结果的平均值为pKa2=9.96± 0.01.
| Table 1 Determination of pKa1 of glycitein* |
| Table 2 Determination of pKa2 of glycitein* |
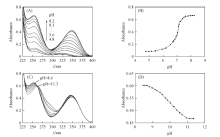
黄豆黄素水溶液在不同pH条件下的荧光激发光谱(ex)和发射光谱(em)如图3(A)所示, 荧光强度随着pH值的变化如图3(B)所示. 在pH< 5.0时, 黄豆黄素水溶液基本无荧光; pH> 5.0之后, 随着pH值的升高, 荧光增强, 激发波长λ ex为258和347 nm, 发射波长λ em为456 nm; 在pH=8.1~9.1范围内, 荧光达到最强且基本稳定; pH> 9.1之后, 荧光强度随着pH值升高而降低, 荧光波长不变. 这些光谱特征表明, 黄豆黄素在pH变化(质子电离)过程中有1种型体可以产生荧光.
根据前述关于吸收光谱和质子电离的讨论可以推断, 黄豆黄素在pH=5.0~8.1范围内的荧光增强是由于发生了7-OH质子的电离, 生成了一价阴离子, 此型体有荧光; 在pH> 9.1之后, 荧光随着pH值升高而减弱, 是由于4'-OH的质子电离, 生成了二价阴离子, 此型体基本无荧光. 以硫酸奎宁为参比, 在激发波长334 nm处, 测得黄豆黄素一价阴离子的弱碱性溶液(pH=8.4)的荧光量子产率为0.049.
考虑到某些黄酮和黄烷酮类化合物可以在热碱性条件下发生C环裂解反应而导致荧光增强[19, 20], 异黄酮类化合物也能在热碱性条件下发生C环裂解反应, 生成一分子甲酸和邻羟基苯基苄基酮衍生物[21], 我们对黄豆黄素的强碱性溶液(此时为二价阴离子, 无荧光)进行了加热, 但未观察到荧光增强, 表明黄豆黄素发生C环裂解反应(见Scheme 2)的产物无荧光.
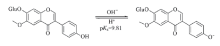
考察了黄豆黄苷水溶液在不同pH条件下的吸收光谱, 如图4(A)所示, 280 nm处的吸光度随pH值的变化如图4(B)所示. 在pH< 8.0时, 黄豆黄苷的吸收峰位于256和320 nm处, 不随pH的变化而改变(这一点与黄豆黄素不同). pH> 8.0之后, 随着pH升高, 256 nm吸光度降低, 280 nm处吸光度升高, 在266 nm以及320和340 nm形成了等色点. 在pH> 11.5之后, 吸收光谱不再随pH的变化而改变. 此光谱特征表明, 黄豆黄苷的存在形态在pH=8.0~11.5范围内发生了变化. 由图1可知, 黄豆黄苷分子结构中7位氧苷(7-OGlu)的存在使其结构没有7-OH, 仅有4'-OH, 为一元有机弱酸. 图4中的光谱变化对应于4'-OH质子的电离, 如Scheme 3所示.
 | Fig.4 Absorption spectra of glycitin aqueous solutions at different pH values(A) and relationship between absorbance and pH value(B) c: 8.20 μ g/mL, volume fraction of MeOH: 10%, λ =280 nm. |
依据图4(B)中的pH-A数据, 由式(1)计算出黄豆黄苷4'-OH质子的电离常数, 结果列于表3, 4次计算结果的平均值为pKa=9.81± 0.03.
| Table 3 Determination of pKa of glycitin* |
比较黄豆黄素与黄豆黄苷的吸收光谱与电离常数可见, 黄豆黄素因7-OH质子的电离导致在pH=5.0~8.0范围内吸收光谱的变化[图2(A)], 而黄豆黄苷在pH< 8.0时吸收光谱无变化; 两者4'-OH质子电离导致的光谱变化[图2(C)和图4(A)]相似, 电离常数(pKa2=9.96和pKa=9.81)相近. 由于7-O-离子的供电子作用强于7-OGlu, 故黄豆黄素的pKa2略大于黄豆黄苷的pKa.
室温下黄豆黄苷水溶液在各种pH条件下均基本无荧光, 这是因为黄豆黄苷结构中没有7-OH, 不能像黄豆黄素那样因7-OH质子电离而产生荧光. Scheme 3中黄豆黄苷4'-OH质子电离前后的2种型体均为非荧光型体.
但是, 实验中发现, 在碱性条件下黄豆黄苷水溶液加热后能产生较强荧光(图5). 在pH> 9.8时, 荧光随着pH升高而增强, λ ex位于246和307 nm处, λ em位于415 nm处. 在pH> 13.2之后, 荧光强度随着pH升高而降低, 但荧光波长不变, 没有新的荧光峰产生. 这种光谱特征表明, 在热碱性溶液中黄豆黄苷发生了化学反应, 其反应产物有荧光, 这种荧光产物会在更高的pH条件下进一步反应, 导致荧光猝灭. 以硫酸奎宁为参比, 在激发波长307 nm处, 测得黄豆黄苷热碱性溶液(pH=13.2)中反应产物的荧光量子产率为0.056.
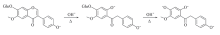
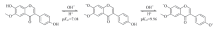
从分子结构看, 黄豆黄苷在热碱性条件下发生化学反应的可能方式有2种: 一是7-氧苷键水解反应(据文献[22, 23]报道, 异黄酮苷在一些特殊酶的存在下能转化成相应的苷元); 二是γ -吡喃酮环裂解反应[21]. 如果先发生了7-氧苷键的水解反应, 则反应产物如同黄豆黄素7-OH质子电离之后的一价阴离子, 其荧光光谱如图3所示(λ ex =258, 337 nm, λ em=456 nm), 但图5中的λ ex(246和307 nm)和λ em(415 nm)与图3明显不同; 如果考虑到在碱性条件下黄豆黄苷4'-OH质子电离, 则7-氧苷键水解反应的产物如同黄豆黄素二价阴离子, 此型体无荧光(图3). 因此, 黄豆黄苷在热碱性条件下不是先发生7-氧苷键水解反应. 另外一种可能是黄豆黄苷发生了γ -吡喃酮环裂解反应, 如Scheme 4所示. 与黄豆黄素一价阴离子相比, 裂解产物的共轭程度较低, 荧光波长应该更短, 这一推测与图5结果一致. 由此可以推断, 黄豆黄苷在热碱性条件下先发生γ -吡喃酮环裂解反应, 产物有荧光; 在pH> 13.4之后, 随着pH升高并加热, 裂解产物进一步发生了7-氧苷键水解反应, 水解产物的分子结构与Scheme 2中的裂解产物相同, 从而导致荧光猝灭. 综上, 黄豆黄苷在热碱性条件下的裂解、 水解过程可推断如Scheme 4所示.
由上述讨论可见, 虽然黄豆黄素与黄豆黄苷分子结构相似, 但二者的荧光性质相差甚远: 黄豆黄素在室温及弱碱性条件下自身能产生荧光(内源荧光); 而黄豆黄苷自身不能产生荧光, 但能在热碱性条件下发生裂解反应, 生成新的荧光化合物.
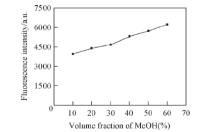
在pH=8.8条件下, 考察了水溶液中甲醇的体积分数对黄豆黄素荧光的影响. 结果(图6)表明, 在水溶液中甲醇的体积分数发生变化时, 荧光波长基本不变, 但荧光强度明显增强. 本文在研究其它实验条件对荧光的影响时, 均控制水溶液中甲醇的体积分数为10%.
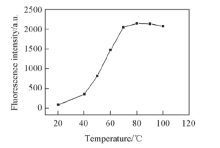
黄豆黄苷强碱性溶液(pH=13.2)在室温下放置几乎不产生荧光. 随着加热温度的升高, 其荧光增强, 表明裂解反应加速. 当温度> 80 ℃时, 荧光达到最强, 表明裂解反应基本完成. 不同加热温度下荧光峰的位置和光谱形状与图5相同, 荧光强度随加热温度的变化如图7所示.
黄豆黄素弱碱性溶液在室温下放置时, 荧光基本稳定. 持续用氙灯照射, 其荧光强度随着光照时间的延长而明显降低. 因此, 重复测试荧光光谱时需更换溶液. 黄豆黄苷强碱溶液在室温下几乎无荧光. 随着加热时间的延长, 荧光随之增强; 加热1.5 h后, 裂解产物的荧光趋于稳定. 持续用氙灯照射裂解产物溶液, 荧光强度无明显变化, 表明荧光性质基本稳定.
黄豆黄素与黄豆黄苷是苷元与苷的关系, 二者分子结构相似, 但吸收光谱和荧光性质存在显著差异. 黄豆黄素属于二元有机弱酸, 分子中的7-OH和4'-OH可在溶液pH值升高时先后电离(pKa1=7.08, pKa2=9.96), 形成一价阴离子和二价阴离子, 导致吸光系数增大, 吸收波长红移. 黄豆黄苷分子中只含有4'-OH, 属于一元有机弱酸, 4'-OH质子的电离(pKa=9.81)导致吸收波长红移. 黄豆黄素在室温弱碱性条件下形成的一价阴离子能产生荧光, 因此黄豆黄素的荧光属于(自身的)内源荧光; 而黄豆黄苷在室温和各种pH条件下均不能产生荧光, 但能在热碱性条件下发生γ -吡喃酮环裂解反应, 生成新的荧光化合物. 在实验中, 黄豆黄苷在热碱性条件下先发生γ -吡喃酮环裂解反应, 然后在更高pH条件下发生糖苷键水解反应. 不能通过在碱性条件下加热的方法使黄豆黄苷的糖苷键水解转变成黄豆黄素. 本文结果为建立二者的荧光分析方法奠定了基础, 也为研究其它异黄酮类化合物的荧光性质提供了参考.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|